
【题目】铝酸钙(mCaO·nAl2O3)是一系列由氧化钙和氧化铝在高温下烧结而成的无机化合物,被应用于水泥和灭火材料中,工业上用石灰石(主要成分为CaCO3和MgCO3)和铝土矿(主要成分是Al2O3、Fe2O3、SiO2等)制备铝酸钙的流程如图:
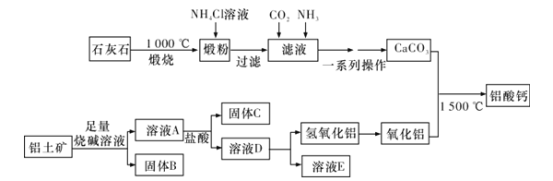
回答下列问题:
(1)固体B的主要成分是__(填化学式);一系列操作包括过滤、洗涤、干燥,洗涤过程应如何操作?__。
(2)向滤液中通入CO2和NH3的顺序为__,其理由是__。
(3)溶液D转化为Al(OH)3;离子方程式是__。
(4)常温下,用适量的NH4Cl溶液浸取煅粉后,若要保持滤液中c(Mg2+)小于5×10-6mol·L-1,则溶液的pH应大于__[已知:Mg(OH)2的K=5×10-12]。
(5)假设上述过程每一步均完全反应,最终得到的铝酸钙(3CaO·7Al2O3)的质量刚好等于原铝土矿的质量,该铝土矿中Al的质量分数为__(计算结果保留三位有效数字)。
【答案】Fe2O3 向漏斗中加水至浸没固体,待水自然流尽后,重复此操作2~3次 先通NH3,后通CO2 NH3易溶于水且可提供碱性环境,更有利于吸收CO2参加反应(合理即可) Al3++3NH3·H2O==Al(OH)3↓+3NH4+ 11 42.9%
【解析】
工业上用石灰石(主要成分为CaCO3和MgCO3)高温煅烧,生成煅粉的主要成分为CaO和MgO,加入NH4Cl溶液,MgO最后转化为Mg(OH)2沉淀,CaO转化为CaCl2,通入NH3、CO2后,生成CaCO3沉淀。铝土矿(主要成分是Al2O3、Fe2O3、SiO2等)中加入足量NaOH溶液,Al2O3、SiO2都发生反应,生成NaAlO2、Na2SiO3进入溶液A,Fe2O3不溶而成固体B;溶液A中加入盐酸,Na2SiO3转化为H2SiO3沉淀(固体C),NaAlO2转化为AlCl3(溶液D);溶液D中通入NH3或加入氨水,生成Al(OH)3沉淀和溶液E(NH4Cl);Al(OH)3沉淀受热分解生成Al2O3,Al2O3与CaCO3高温反应生成铝酸钙。
(1)由以上分析可知,固体B的主要成分是Fe2O3;一系列操作包括过滤、洗涤、干燥,洗涤过程中,注意选择洗涤剂(难溶于水,用水洗)、加入量及操作方法,具体操作为:向漏斗中加水至浸没固体,待水自然流尽后,重复此操作2~3次。答案为:Fe2O3;向漏斗中加水至浸没固体,待水自然流尽后,重复此操作2~3次;
(2)因为CO2在水中的溶解度不大,若先通CO2,即便NH3的溶解度大,但最终生成的CaCO3也不会太多,所以应向滤液中先通入NH3,后通入CO2,因为NH3易溶于水且可提供碱性环境,更有利于吸收CO2参加反应(合理即可)。答案为:先通NH3,后通CO2;NH3易溶于水且可提供碱性环境,更有利于吸收CO2参加反应(合理即可);
(3)溶液D中通入NH3或加入氨水,生成Al(OH)3沉淀和NH4Cl溶液,反应的离子方程式是Al3++3NH3·H2O==Al(OH)3↓+3NH4+。答案为:Al3++3NH3·H2O==Al(OH)3↓+3NH4+;
(4) K=5×10-12= c(Mg2+)×c2(OH-),c(Mg2+)小于5×10-6mol·L-1,则c(OH-)>1×10-3mol·L-1,pH=-lgc(H+)>11。答案为:11;
(5)假设铝酸钙(3CaO·7Al2O3)为1mol,则质量为3×56+7×102=882g,原铝土矿的质量为882g,该铝土矿中Al的质量分数为![]() =42.9%。答案为:42.9%。
=42.9%。答案为:42.9%。


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】图1表示:以相同的滴速分别向同体积的蒸馏水和0.1 mol/L CuSO4溶液中滴入NaCl溶液,氯离子浓度随氯化钠加入量的变化关系。图2表示:CuCl2溶液中氯离子浓度随温度变化关系。结合信息,下列推断不合理的是
已知:CuSO4溶液中存在平衡X:Cu2++4H2O![]() [Cu(H2O)4]2+(蓝色)
[Cu(H2O)4]2+(蓝色)
CuCl2溶液呈绿色,溶液中存在平衡Y:4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O
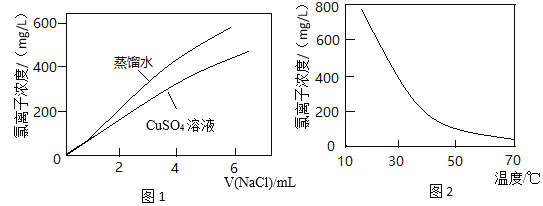
A.平衡Y是图1中两条曲线没有重合的主要原因
B.由图2可知平衡Y为吸热反应
C.平衡X是无水硫酸铜粉末和硫酸铜溶液颜色不同的原因
D.CuCl2溶液加水稀释,溶液最终变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
![]()
A.D结构简式为CH3COOCH2CH3B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应D.可用B萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SiHCl3(g)= SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
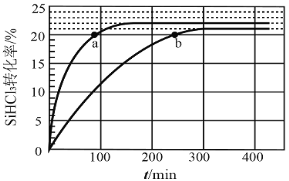
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是__________,要缩短反应达到平衡的时间,可采取的措施有_____________。
③比较a、b处反应速率大小:υa______υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =________(保留1位小数)。
=________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
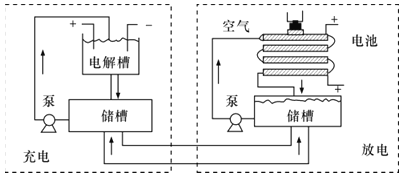
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种药物中间体(G)的一种合成路线如图:

已知:
请回答下列问题:
(1)R的名称是__;R中官能团名称是__。
(2)M→N的反应类型是__。P的结构简式为__。
(3)H分子式是__。
(4)写出Q→H的化学方程式:__。
(5)T是一种与R具有相同官能团的芳香化合物(且组成元素种类相同),T的相对分子质量比R多14。T有__种结构。其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式可能有__。
(6)以1,5-戊二醇(![]() )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成![]() ,设计合成路线:__。
,设计合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是( )
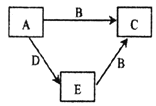
A.四种元素简单离子半径比较:W>Y>Z>X
B.Y的氢化物与Y的最高价氧化物的水化物反应生成盐
C.X、Y、W组成的化合物中一定既有离子键又有极性键
D.W是所在周期中原子半径最小的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是中学化学常见的四个装置,下列关于这些装置说法正确的是
A.装置在使用过程中,电池内部电子从Ag2O 极通过隔板移向锌粉
B.装置在使用过程中,电池外壳会逐渐变薄,容易出现漏液
C.装置在使用过程中,电解质溶液的 pH 不会发生变化
D.装置在使用过程中,阳极可以一直使用,不需要更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com