
【题目】以下是中学化学常见的四个装置,下列关于这些装置说法正确的是
A.装置在使用过程中,电池内部电子从Ag2O 极通过隔板移向锌粉
B.装置在使用过程中,电池外壳会逐渐变薄,容易出现漏液
C.装置在使用过程中,电解质溶液的 pH 不会发生变化
D.装置在使用过程中,阳极可以一直使用,不需要更换
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝酸钙(mCaO·nAl2O3)是一系列由氧化钙和氧化铝在高温下烧结而成的无机化合物,被应用于水泥和灭火材料中,工业上用石灰石(主要成分为CaCO3和MgCO3)和铝土矿(主要成分是Al2O3、Fe2O3、SiO2等)制备铝酸钙的流程如图:
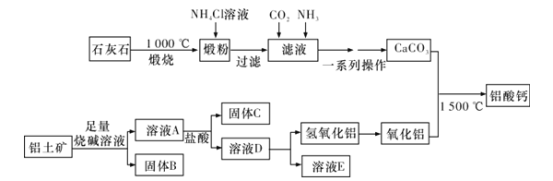
回答下列问题:
(1)固体B的主要成分是__(填化学式);一系列操作包括过滤、洗涤、干燥,洗涤过程应如何操作?__。
(2)向滤液中通入CO2和NH3的顺序为__,其理由是__。
(3)溶液D转化为Al(OH)3;离子方程式是__。
(4)常温下,用适量的NH4Cl溶液浸取煅粉后,若要保持滤液中c(Mg2+)小于5×10-6mol·L-1,则溶液的pH应大于__[已知:Mg(OH)2的K=5×10-12]。
(5)假设上述过程每一步均完全反应,最终得到的铝酸钙(3CaO·7Al2O3)的质量刚好等于原铝土矿的质量,该铝土矿中Al的质量分数为__(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
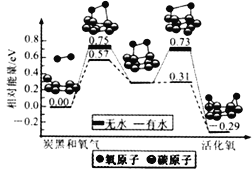
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
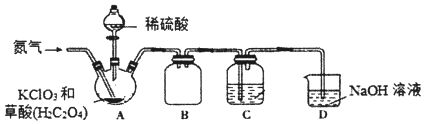
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液

回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④。
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是_________________________________(填字母)。
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体_______(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)煤气化制合成气(CO和H2)
已知:C(s)+H2O(g)===CO(g)+H2(g)ΔH2=131.3kJ·mol1
C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH2=90kJ·mol1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是_____
(2)由合成气制甲醇
合成气CO和H2在一定条件下能发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。
CH3OH(g)ΔH<0。
①在容积均为VL的甲、乙、丙、丁四个密闭容器中分别充入amolCO和2amolH2,四个容器的反应温度分别为T1、T2、T3、T4且恒定不变。在其他条件相同的情况下,实验测得反应进行到tmin时H2的体积分数如图所示,则T3温度下的化学平衡常数为_____(用a、V表示)
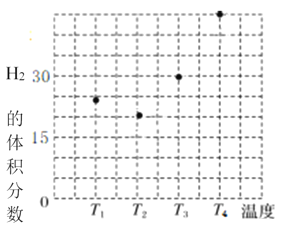
②图反映的是在T3温度下,反应进行tmin后甲醇的体积分数与反应物初始投料比![]() 的关系,请画出T4温度下的变化趋势曲线。______________
的关系,请画出T4温度下的变化趋势曲线。______________
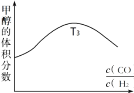
③在实际工业生产中,为测定恒温恒压条件下反应是否达到平衡状态,可作为判断依据的是_____
A.容器内气体密度保持不变 B.CO 的体积分数保持不变
C.气体的平均相对分子质量保持不变 D.c(H2)=2c(CH3OH)
(3)由甲醇制烯烃
主反应:2CH3OH![]() C2H4+2H2O i;
C2H4+2H2O i;
3CH3OH![]() C3H6+3H2O ii
C3H6+3H2O ii
副反应:2CH3OH![]() CH3OCH3+H2O iii
CH3OCH3+H2O iii
某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行甲醇制烯烃的对比研究,得到如下实验数据(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
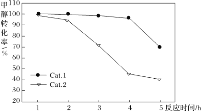
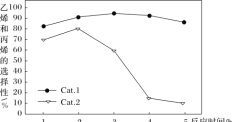
由图像可知,使用Cat.2反应2h后甲醇的转化率与乙烯和丙烯的选择性均明显下降,可能的原因是(结合碰撞理论解释)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如下图所示。下列说法不正确的是

A. 每消耗3mol H2O2,转移6mol e-
B. 电池工作时Na+从b极区移向a极区
C. b极上的电极反应式为:H2O2 + 2e-= 2OH-
D. a极上的电极反应式为:BH4-+ 8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com