
【题目】常温下,有下列五种溶液

回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④。
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是_________________________________(填字母)。
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体_______(填“多”、“少”或“相等”)。
【答案】> > BC AB 多
【解析】
(1)醋酸是弱酸,不能完全电离,0.1molL-1CH3COOH溶液稀释100倍后,浓度为0.001mol/L;0.1molL-1CH3COOH溶液中c(H+)小于0.1mol/L,0.1molL-1NaOH溶液,c(OH-)=0.1mol/L,据此分析;
(2)在相同温度时,10mL0.1molL-1CH3COOH溶液与100mL0.01molL-1CH3COOH溶液所含醋酸的物质的量相同,醋酸浓度越小,其电离程度越大,但氢离子浓度减小,据此分析;
(3)用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2OOH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
(4)醋酸是弱酸,没有完全电离,盐酸是强酸,已经完全电离。
(1)醋酸是弱酸,不能完全电离,0.001mol/L的CH3COOH pH大于3;0.1molL1CH3COOH溶液中c(H+)小于0.1mol/L,0.1molL1NaOH溶液, c(OH)=0.1mol/L,c(H+)或c(OH)越大,其对水的电离平衡的影响越大,所以由水电离出来的氢离子浓度①>④,故答案为:>;>;
(2)10mL0.1molL1CH3COOH溶液与100mL0.01molL1CH3COOH溶液所含醋酸的物质的量相同,所以中和NaOH的物质的量相同,故AD错误; 醋酸浓度越小,其电离程度越大,醋酸浓度越小,其酸性越弱,氢离子浓度减小,对水的电离平衡的影响越小,故BC正确;
故答案为:BC;
(3)A.氨水加水稀释,溶液的浓度减小,碱性减弱,氢氧根的浓度减小,根据温度不变,则c(H+)和c(OH)的乘积不变,所以氢氧根的浓度减小,氢离子浓度增大,故A正确;
B.由NH3·H2O OH+NH4+可知,加水促进电离,则c(NH3·H2O)减少, c(OH)减小,但是平衡正向移动,氨水的浓度减小得多,所以分母减小的程度大,分子减小的程度小,二者的比值减小,故B正确;
C.因加水稀释时,温度不变,则c(H+)和c(OH)的乘积不变,故C错误;
D.由NH3·H2O OH+NH4+可知,加水促进电离,OH的物质的量增大,故D错误;
故答案为:AB;
(4)由于醋酸部分电离,盐酸完全电离,所以pH相等、体积相等的醋酸和盐酸溶液,醋酸的物质的量大,所以加入足量Zn,醋酸产生的氢气多,故答案为:多。


科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是

A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种药物中间体(G)的一种合成路线如图:

已知:
请回答下列问题:
(1)R的名称是__;R中官能团名称是__。
(2)M→N的反应类型是__。P的结构简式为__。
(3)H分子式是__。
(4)写出Q→H的化学方程式:__。
(5)T是一种与R具有相同官能团的芳香化合物(且组成元素种类相同),T的相对分子质量比R多14。T有__种结构。其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式可能有__。
(6)以1,5-戊二醇(![]() )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成![]() ,设计合成路线:__。
,设计合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K=![]() ,请写出此反应的热化学方程式___。
,请写出此反应的热化学方程式___。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.35 | 0.35 |
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=__;1.00min~3.00min内,O2的平均反应速率为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析B极发生的电极反应式为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是中学化学常见的四个装置,下列关于这些装置说法正确的是
A.装置在使用过程中,电池内部电子从Ag2O 极通过隔板移向锌粉
B.装置在使用过程中,电池外壳会逐渐变薄,容易出现漏液
C.装置在使用过程中,电解质溶液的 pH 不会发生变化
D.装置在使用过程中,阳极可以一直使用,不需要更换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某浅黄色固体化合物X(含四种元素)的组成。某化学兴趣小组称取 3.60g 该固体化合物,用热重法对其进行分析,得到剩余固体的质量随温度变化的曲线如图所示。
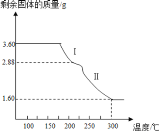
已知:① 热分解后得到的无色无味气体能完全被足量澄清石灰水吸收,并得到 4.00g白色沉淀;
② 热分解后剩余的固体呈红棕色,溶于盐酸后得到黄色溶液。请回答:
(1)X 的化学式是_____。
(2)固体X 在 300℃下反应的化学方程式是_____。
(3)将热分解后剩余的红棕色继续升温加热至一定温度,可生成1.55g黑色固体(纯净物),请设计实验方案检验黑色固体中的阳离子_____。
(4)该兴趣小组进一步查阅资料发现,在隔绝空气加热条件下,该化合物 X 还生成黑色能自燃并且具有铁磁性的粉末。则其可能发生的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

(1)原NaOH溶液的物质的量浓度_________________。
(2)B份混合溶液与盐酸反应产生气体的最大体积为________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钒(VO2)是一种新型热敏材料。实验室以V2O5为原料合成用于制备VO2的氧钒( IV )碱式碳酸铵晶体,过程如下:
V2O5![]() VOCl2溶液
VOCl2溶液![]() (NH4)5[(VO)6(CO3)4(OH)9]10·H2O
(NH4)5[(VO)6(CO3)4(OH)9]10·H2O
回答下列问题:
(1)步骤i中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为____。也可只用浓盐酸与V2O5来制备VOCl2溶液,从环境角度考虑,该方法的缺点是_______。
(2)步骤ii可在如图装置(气密性良好)中进行。已知:VO2+能被O2氧化。

①药品填装完成后的实验操作是____(填活塞“a”“b”的操作)。
②若无装置B,则导致的后果是____。
(3)加完VOCl2后继续搅拌数分钟,使反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于CO2保护下的干燥器中,静置过夜,得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,除去水分,再用乙醚洗涤2次,抽干称重。用饱和NH4 HCO3溶液洗涤除去的阴离子主要是____。
(4)测定氧钒( IV )碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加0.02 mol·L-1的KMnO4溶液至稍过量,充分反应后继续加1% NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 ,最后用0.08 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为30.00 mL。(滴定反应:VO2+ + Fe2++2H+=VO2++ Fe3++H2O)
①NaNO2溶液的作用是____。
②粗产品中钒的质量分数为____(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com