
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
【答案】溶解氧化锌,将其与氧化亚铁和氧化铜分离 ZnO+2NaOH=Na2ZnO2+H2O CuO、FeO Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3 Zn(OH)2+2H+=Zn2++2H2O 蒸发浓缩 冷却结晶
【解析】
炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)中加入NaOH,由于ZnO具有两性,能与NaOH反应生成Na2ZnO2和H2O,而CuO和FeO不溶,于是成为沉淀A的主要成分;滤液中通入过量CO2调节pH,Na2ZnO2生成Zn(OH)2沉淀,CO2转化为NaHCO3;加入盐酸酸溶,Zn(OH)2转化为ZnCl2;蒸发浓缩、冷却结晶,过滤、洗涤、干燥,便可获得氯化锌晶体。
(1)从以上分析可知,碱溶时加入过量NaOH溶液,ZnO与NaOH反应生成Na2ZnO2和H2O,而CuO和FeO不溶,从而得出其目的是溶解氧化锌,将其与氧化亚铁和氧化铜分离;发生反应的化学方程式是ZnO+2NaOH=Na2ZnO2+H2O。答案为:溶解氧化锌,将其与氧化亚铁和氧化铜分离;ZnO+2NaOH=Na2ZnO2+H2O;
(2)因为加入NaOH后,CuO和FeO不溶,所以沉淀A的主要成分的化学式是CuO、FeO。答案为:CuO、FeO;
(3) “调pH”步骤中通入过量CO2,Na2ZnO2生成Zn(OH)2沉淀,CO2转化为NaHCO3,化学反应方程式Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3。答案为:Na2ZnO2+2CO2+2H2O=Zn(OH)2↓+2NaHCO3;
(4)酸溶时,Zn(OH)2与盐酸反应,转化为ZnCl2和水,发生反应的离子方程式是Zn(OH)2+2H+=Zn2++2H2O。答案为:Zn(OH)2+2H+=Zn2++2H2O;
(5)从溶液中提取溶质,需要蒸发结晶,所以一系列操作过程中的一系列操作是:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。答案为:蒸发浓缩;冷却结晶。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,有下列五种溶液

回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH______③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①_______④。
(2)在相同温度时,10mL ①的溶液与100mL②的溶液相比较,下列数值后者大于前者的是_________________________________(填字母)。
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是______(填字母)。
A.C(OH-) B.C(NH3·H2O)/C(OH-)
C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)在体积相等、pH相等的 ③ 溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体_______(填“多”、“少”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.pH之和为14的H2C2O4与NaOH溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
C.0.1mol/L的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
D.将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:

下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D. 无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应得到一种离子化合物,B的一种单质具有杀菌消毒的作用,C+和D3+的电子层结构相同,E的主族序数是其周期序数的2倍。
(1)F在元素周期表中的位置是__________________。
(2)上述元素形成的简单离子中,半径最大的是____________(填离子符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:

①若丙具有漂白性,则甲和水反应的离子方程式为__________________________。
②若乙的水溶液是强碱性溶液,物质丙为B的一种单质,则甲中含有的化学键的类型为________,D的单质与乙的水溶液反应的离子方程式为_________________。
③若甲为D和E形成的二元化合物,物质丙是气体,则丙的结构式为___________;物质乙为白色沉淀,其化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
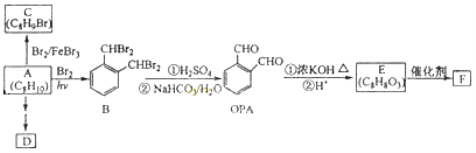
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①A中盛装氢氧化钠溶液的仪器名称为______________,制取次氯酸钠和氧氧化钠混合液的连接顺序为_______________________(按气流方向,用小写字母表示)。
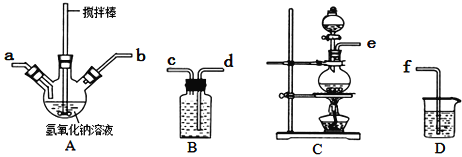
若该实验温度控制不当,反应后测得三颈瓶内ClO与ClO3的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到到另一种溶液中(填“NaClO溶液”或“尿素溶液”),且该溶液应该________滴加。(填“快速”或“不宜过快”)
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
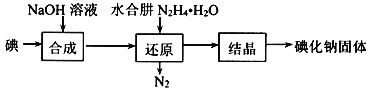
在“还原”过程中,主要消耗反应过程中生成的副产物IO3,该过程的离子方程式为______________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是______________
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L1的Na2S2O3标准溶液滴定至终点(反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com