
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
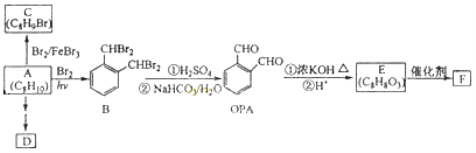
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
【答案】
(1)邻二甲苯(1分)
(2)取代反应(1分) 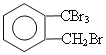 (1分)
(1分)
(3) (2分)
(2分)
(4)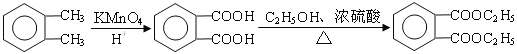 (2分)
(2分)
(5)邻苯二甲醛(1分) 缩聚反应(1分)
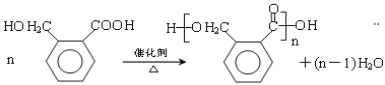 (2分)
(2分)
(6)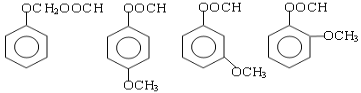 (4分)
(4分)
【解析】
(1)由合成路线图知:芳香化合物A分子式为C8H10,且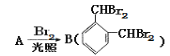 可推知A为邻二甲苯;
可推知A为邻二甲苯;
(2)A→B的反应类型是取代反应,因取代反应是连锁反应,有多种副产物。 所以与B互为同分异构体的化合物的结构简式为: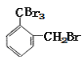
(3)A→C(C8H9Br),条件是Br2/FeBr3,可知发生的是苯环上的取代,又因甲基是邻、对位定位基,则C的可能结构简式有两种分别是: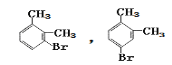
(4)D为邻苯二甲酸二乙酯,A→D经两步合成,可先用酸性K2MnO4将邻二甲苯氧化为邻苯二甲酸;然后再与乙醇发生酯化反应制得。
(5)由OPA的结构简式知其名称为邻苯二甲醛,易错命名为邻二苯甲醛,注意命名时应以官能团醛基为母体。OPA→E(C8H8O3),结合题给信息可知:在此条件下—CHO即可被氧化为—COOH又能被还原为—CH2OH,所以中间体E的结构简式为:![]() ;该有机物因有—COOH和—OH两种官能团,则可发生缩聚反应合成一种聚酯类高分子F,其反应为:
;该有机物因有—COOH和—OH两种官能团,则可发生缩聚反应合成一种聚酯类高分子F,其反应为: 。
。
(6)芳香化合物G是E的同分异构体,分析E的侧链可知:不饱和度=1,C原子数=2,O原子数=3,又由题干信息知其分子中含有—CHO、—COO—和—O—三种含氧官能团,综合分析得:若含一个支链则为:—OCH2OOCH;若含两个支链则分别为—OCH3和—OOCH;且它们在苯环上的位置有邻、间、对三种,所以符合条件的G的同分异构体共有4种。


科目:高中化学 来源: 题型:
【题目】取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

(1)原NaOH溶液的物质的量浓度_________________。
(2)B份混合溶液与盐酸反应产生气体的最大体积为________mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
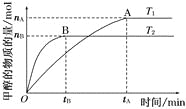
下列说法正确的是_______(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体(ZnCl2·xH2O)的工艺流程如图:
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22-。
(1)碱溶时加入过量NaOH溶液的目的是___,发生反应的化学方程式是___。
(2)沉淀A的主要成分的化学式是___。
(3) “调pH”步骤中通入过量CO2,化学反应方程式___。
(4)酸溶时发生反应的离子方程式是___。
(5)一系列操作过程中的一系列操作是:___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(![]() )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产
)生产![]() 的流程如图所示:
的流程如图所示:
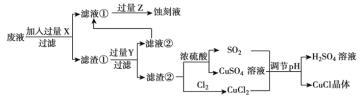
根据以上信息回答下列问题:
(1)生产过程中:X是________,Z是________。(均填化学式)
(2)写出生成![]() 的离子方程式________。
的离子方程式________。
(3)析出的![]() 晶体不用水而用无水乙醇洗涤的原因是________。
晶体不用水而用无水乙醇洗涤的原因是________。
(4)在![]() 的生成过程中理论上不需要补充SO2气体,其理由是________。
的生成过程中理论上不需要补充SO2气体,其理由是________。
(5)已知:常温下![]() ,
,![]() ,现向
,现向![]() 饱和溶液中加入
饱和溶液中加入![]() 固体至
固体至![]() ,此时溶液中
,此时溶液中![]() =________。
=________。
(6)实验探究pH对![]() 产率的影响如下表所示:
产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出![]() 晶体最佳pH为________,当pH较大时
晶体最佳pH为________,当pH较大时![]() 产率变低的原因是________。
产率变低的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:
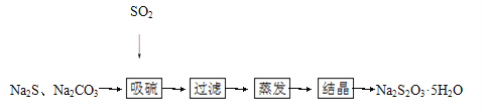
(1)吸硫装置如图所示:
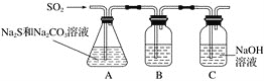
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com