
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

【答案】哑铃(或纺锤) ![]() 或
或![]() V形 液氨存在分子间氢键,沸点高于
V形 液氨存在分子间氢键,沸点高于![]() ,故
,故![]() 比
比![]() 更易液化
更易液化 
![]() 两种离子的中心硫原子均为
两种离子的中心硫原子均为![]() 杂化,
杂化,![]() 中没有孤对电子,
中没有孤对电子,![]() 有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小 正四面体 12
有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小 正四面体 12 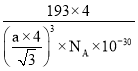
【解析】
(1)N原子的外围电子的最高能级为2p能级;
(2)NO3-中N的价电子数为5,离子带一个单位负电荷,相当价电子数为6 的S原子,据此分析书写等电子体;根据价层电子对个数=σ键个数+孤电子对个数,计算判断NH2-的VSEPR;结合氢键形成条件分析判断;
(3)该配离子中Cu原子提供空轨道、N原子提供孤电子对而形成配位键;根据价层电子对个数=σ键个数+孤电子对个数推断SO42-的和SO32-的VSEPR模型,结合孤电子对会成键电子对的排斥力大于成键电子对之间的排斥力分析键角大小;
(4)根据均摊法结合图象分析计算;顶点与面心的Te原子之间距离最短,每个顶点为8个晶胞共用,每个面为2个晶胞共用;与Zn原子距离最近的Te原子间距等于晶胞体对角线长的![]() 倍,根据均摊法计算晶胞中Te、Zn原子数目,结合原子的摩尔质量计算晶胞质量,再根据ρ=
倍,根据均摊法计算晶胞中Te、Zn原子数目,结合原子的摩尔质量计算晶胞质量,再根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)N原子的外围电子排布式为2s22p3,最高能级为2p,p轨道为哑铃形,故答案为:哑铃;
(2)NO3-中N的价电子数为5,离子带一个单位负电荷,相当价电子数为6 的S原子,所以与NO3-互为等电子体的分子为SO3;NH2-中N的价层电子对数为2+![]() =4,含有两对孤电子对,VSEPR模型为四面体,略去孤电子对,得到NH2-的空间构型为V形;NH3中含有电负性大的N原子、并且有N-H键,符合氢键形成条件,所以NH3分子间存在氢键,沸点高于PH3,导致NH3比PH3更容易液化,故答案为:SO3;v形;液氨存在分子间氢键,沸点高于PH3,所以NH3比PH3更容易液化;
=4,含有两对孤电子对,VSEPR模型为四面体,略去孤电子对,得到NH2-的空间构型为V形;NH3中含有电负性大的N原子、并且有N-H键,符合氢键形成条件,所以NH3分子间存在氢键,沸点高于PH3,导致NH3比PH3更容易液化,故答案为:SO3;v形;液氨存在分子间氢键,沸点高于PH3,所以NH3比PH3更容易液化;
(3)该配离子中Cu原子提供空轨道、N原子提供孤电子对而形成配位键,其结构为 ;SO42-中S的价层电子对数为4+
;SO42-中S的价层电子对数为4+![]() =4,没有孤电子对,VSEPR模型分别为正四面体,SO42-中的硫原子杂化方式为sp3杂化; SO3/span>2-中S的价层电子对数为3+
=4,没有孤电子对,VSEPR模型分别为正四面体,SO42-中的硫原子杂化方式为sp3杂化; SO3/span>2-中S的价层电子对数为3+![]() =4,有1个孤电子对,VSEPR模型分别为四面体,由于SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对和成键电子对间的排斥力大于成键电子对之间的排斥力,孤电子对对成键电子有挤压作用,所以SO32-的键角更小,故答案为:
=4,有1个孤电子对,VSEPR模型分别为四面体,由于SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对和成键电子对间的排斥力大于成键电子对之间的排斥力,孤电子对对成键电子有挤压作用,所以SO32-的键角更小,故答案为: ;sp3;两种离子的中心硫原子均为sp3杂化,SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。
;sp3;两种离子的中心硫原子均为sp3杂化,SO42-中没有孤对电子、SO32-有一对孤对电子,孤电子对对成键电子有挤压作用,因此键角更小。
(4)由图可知中与Zn原子距离最近的Te原子围成正四面体;顶点与面心的Te原子之间距离最短,每个顶点为8个晶胞共用,每个面为2个晶胞共用,与Te原子距离最近的Te原子有![]() ×3×8=12;
×3×8=12;
Zn原子处于晶胞内部,Zn原子数目=4,Te原子处于晶胞的顶点、面心,晶胞中Te原子数目=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() g,与Zn原子距离最近的Te原子间距为apm,该距离等于晶胞体对角线长的
g,与Zn原子距离最近的Te原子间距为apm,该距离等于晶胞体对角线长的![]() 倍,即晶胞边长为
倍,即晶胞边长为![]() pm,晶胞体积V=(
pm,晶胞体积V=(![]() ×1010)3cm3,所以晶体密度ρ=
×1010)3cm3,所以晶体密度ρ=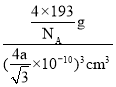 =
=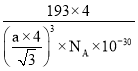 g/cm3,故答案为:正四面体;12;
g/cm3,故答案为:正四面体;12;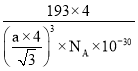 。
。


科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如下图所示。下列说法不正确的是

A. 每消耗3mol H2O2,转移6mol e-
B. 电池工作时Na+从b极区移向a极区
C. b极上的电极反应式为:H2O2 + 2e-= 2OH-
D. a极上的电极反应式为:BH4-+ 8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
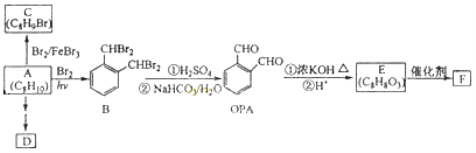
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物,其中A、C、E为有机物。已知A的相对分子质量为28,B分子中含有18个电子,D分子中含有10个电子,五种化合物间的转化关系如下图所示。下列说法正确的是
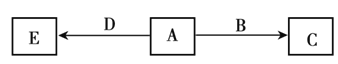
A.W是所在周期中原子半径最大的元素
B.Y的最高价氧化物的水化物为弱酸
C.X、Y、Z组成的分子中只含有极性键
D.X、Y组成的化合物的沸点一定比X、Z组成的化合物的沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可证明NH3·H2O是弱碱的是( )
A.氨水能与氯化镁反应生成氢氧化镁
B.氨水能与硫酸发生中和反应
C.0.2 mol·L-1氨水与0.2 mol·L-1盐酸等体积混合后,溶液pH约为5
D.氨水可以使酚酞溶液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.裂化汽油是一种良好的有机溶剂,可以用于清洗衣物油渍和萃取溴水中的卤素
C.DDT的结构简式为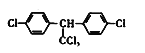 ,分子中最多有13个碳原子共平面
,分子中最多有13个碳原子共平面
D.![]() 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
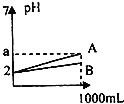
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com