
【题目】下列事实不能用勒夏特列原理解释的是
A. 合成氨工业上增大压强以提高反应物的转化率
B. 黄绿色的氯水光照后颜色变浅
C. 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
【答案】C
【解析】
平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
A.合成氨是气体体积减小的反应,增大压强,平衡向正反应方向移动,能用平衡移动原理解释,故A不选;
B.氯气溶于水的反应是一个可逆反应,Cl2+H2O![]() HClO+H++Cl-,光照条件下,次氯酸分解生成HCl和氧气,生成物浓度降低,平衡正向移动,黄绿色的氯水光照后颜色变浅,可以用平衡移动原理解释,故B不选;
HClO+H++Cl-,光照条件下,次氯酸分解生成HCl和氧气,生成物浓度降低,平衡正向移动,黄绿色的氯水光照后颜色变浅,可以用平衡移动原理解释,故B不选;
C.该反应前后气体体积不变,增大压强平衡不移动,因为体积减小导致碘浓度增大而使颜色加深,所以不能用平衡移动原理解释,故C选;
D.溶液中存在平衡Fe3++6SCN-![]() Fe(SCN)63-,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选;
Fe(SCN)63-,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选;
故选:C。


科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是

A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将木炭磨成直径为10nm左右的炭粒后再分散到某液体分散剂中,对所得分散系的叙述正确的是( )
①一定是溶液 ②有丁达尔效应 ③能全部透过半透膜 ④可以全部透过滤纸
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵的结构相似,它与水反应有气体生成。下列关于氢化铵叙述正确的是
A. 是离子化合物,含有离子键和共价键
B. 电子式是
C. 与水反应时,NH4H是氧化剂
D. 固体投入少量的水中,只产生一种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是( )
A.反应中氮元素被氧化
B.还原性NH4+>Cl-
C.反应中氯元素被还原
D.经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是____________,其含有的化学键类型___________
(3)最高价氧化物是两性氧化物的素是________;写出它的氧化物与盐酸反应的离子方程式_________________________________________
(4)写出元素③的氢化物的电子式______________
(5)写出④的单质与水反应的离子方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .
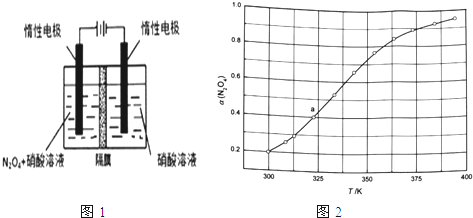
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及 A 中酒精灯已略)。
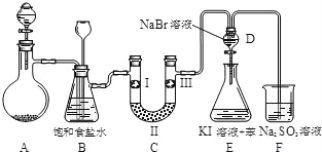
(1)实验室制氯气的离子方程式为_____。
(2)装置 B 中饱和食盐水的作用是_____;请写出装置 B 的另一个作用_______________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性, 为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______________(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,静置,观察到的现象是_____,该现象不能说明溴的非金属性强于碘,原因是_________。
(5)装置 F 中所发生的离子反应方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com