
| 9g |
| 18g/mol |
| 50g |
| 100g/mol |
| 0.5mol |
| 0.1mol |
| 1mol |
| 0.1mol |
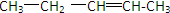 、
、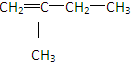 、
、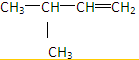 ,
,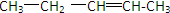 、
、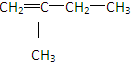 、
、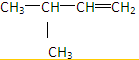 .
.


科目:高中化学 来源: 题型:
| A、FeCl3溶液能使KI淀粉试纸变蓝 |
| B、FeCl3溶液滴入沸水中产生红褐色的胶体 |
| C、FeCl3溶液中加入AgNO3溶液产生白色沉淀 |
| D、FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
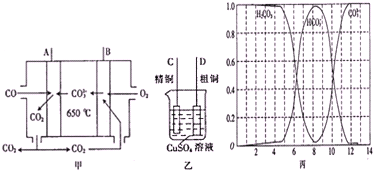
| 某成分的物质的量 |
| 各成分物质的量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
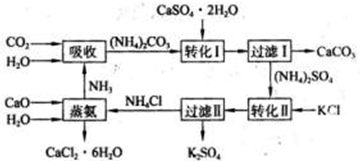
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com