
����Ŀ����ͼaΪ�ں��º����ܱ������зֱ����X��Y��Z�������壬һ�������·�����Ӧ��������Ũ����ʱ��ı仯������t����ʼ��ÿ��ʱ��ֻ�ı�һ���Ҳ�ͬ������������Z�������淴Ӧ������ʱ��仯��ͼb������˵������ȷ����

A. 0��t1min��X��Y��ƽ������֮��Ϊ2��3 B. t2ʱ�̸ı������������ѹǿ�����
C. �÷�Ӧ������ӦΪ���ȷ�Ӧ D. �÷�Ӧ��Zһ��Ϊ����
���𰸡�C
��������A��0��t1min��X��Y�仯�����ʵ� ��Ũ�ȷֱ�Ϊ0.06mol/L��0.09mol/L����X��Y��ƽ������֮��Ϊ2�U3����A��ȷ��B��t1��t2�Ρ�t2��t3����t4��t5�����淴Ӧ���ʶ���ȣ�ÿ��ʱ��ֻ�ı�һ���Ҳ�ͬ��������t2��t3����t4��t5�η�Ӧ���ʼӿ���ƽ�ⲻ�ƶ���˵���ֱ���ʹ���˴����ͼ�ѹ����Ӧǰ������������䣬��B��ȷ��C��t3��t4�θı������Ϊ���ͷ�Ӧ�¶ȣ�ƽ�������ƶ���˵������Ӧ���ȣ���C����D��ÿ��ʱ��ֻ�ı�һ���Ҳ�ͬ��������t2��t3����t4��t5�η�Ӧ���ʼӿ���ƽ�ⲻ�ƶ���˵���ֱ���ʹ���˴����ͼ�ѹ����Ӧǰ������������䣬0-t1ʱ��X����0.09mol/L��Y����0.06mol/L������Zһ�����������D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
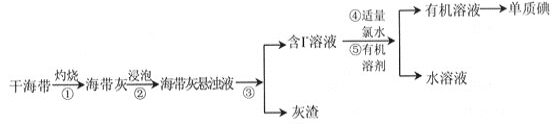
����Ŀ��������Ҫ��������ԭ�ϣ�����һ������ҹ�Ŀǰ�Ƶ����Ҫ������ij�о���ѧϰС��������ף���Ʋ�����������ģ��ʵ�顣
����֪����ˮ�к���CL2���ӣ�Cl2 ��2I�� �� 2Cl�� �� I2��
��ش�
��1������������պ����õ���ʵ��������_____________������ţ���
a. �Թ� b. ���� c. �ձ� d.������
��2������۵�ʵ�������_______________________��
��3�������ʵ������ɷֽ�Ϊ���¼�����
��A�������Һ©���������ϿڵIJ������Ƿ�©ˮ
��B����50������ˮ��15����CCl4�����Һ©���У����Ǻò�����
��C����ת©������������ʱ�����������������رջ�������©������
��D����ʢ����Һ�ķ�Һ©����������̨����Ȧ��
��E�����ã��ֲ�
��F����©���ϿڵIJ�������ʹ���ϵİ��ۻ�С��©�����ϵ�С��
��G���������������ձ�������Һ
��H���ӷ�Һ©���Ͽڵ����ϲ�ˮ��Һ
��������G������IJ���Ŀ����____________________________________��
����ѡ��CCl4�ӵ�ˮ����ȡ���ԭ����___________________________��
����������������������CCl4����_______��
A���� B �ƾ� C NaCl��Һ D NaOH��Һ
��4��ͬѧ�ǹ۲쵽��ɲ���ݺ����õ���ˮ��Һ�ʵ���ɫ��ijͬѧ�ƶ����п��ܺ��еⵥ�ʣ����鷽���ǣ� _______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������������ӦΪ 2NO2(g)��O3(g) ![]() N2O5(g)��O2(g)���й�˵����ȷ������������
N2O5(g)��O2(g)���й�˵����ȷ������������
A. ����ѹǿ������Ӧ���� B. �����¶ȿɼ�С��Ӧ����
C. �ﵽƽ��ʱ��v(��)��v(��)��0 D. �ﵽƽ��ʱ��NO2ת����Ϊ100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������У�����3A+B = 2C ����Ϊ���壩�ķ�Ӧ�����������A��B����4mol�� A��ƽ����Ӧ������0.12mol/(L.s)����10s�������е�B�����ʵ�����
A��1.6mol B��3.2mol C��3.6mol D��2.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���������ֶ�����Ԫ����ɵ�������ǵ�ÿ�������о�����18�����ӣ������Ϣ���±���ʾ(��/����ʾ��Ӧ����Ϣ��ȥ)��
������ | X | Y | Z |
�����к��е�ԭ�Ӹ��� | / | 4 | / |
Ħ������/g��mol��1 | 32 | 34 | / |
�ش��������⣺
(1)X����������ƽ���������ӵ����ģ��Ϊ![]() ��X�Ļ�ѧʽΪ________��
��X�Ļ�ѧʽΪ________��
(2)Y�Ļ�ѧ����������ȷ����________��
a�����ȶ��� b��������
c�������� d����ԭ��
(3)Z�Ļ�ѧʽ����H2A��ʾ����һ������Z����ͨ��0.05 mol��L��1CuSO4��Һ�У�����ǡ����ȫ��Ӧ����֪Ksp(CuA)��6.0��10��36������������Һ����ı仯����
����Ӧ����Һ��pH��________��
������Ӧ����Һ��c(A2��)��2.0��10��30mol��L��1������Һ��c(Cu2��)��________mol��L��1��
(4)��һ������Z����ͨ��NaOH��Һ�У���������Һ����μ���ϡ������������������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ(����������ܽ��HCl�Ļӷ�)��

��0����Һ���������ʵĻ�ѧʽΪ____________��
����֪a����Һ�ʼ��ԣ�����Һ������Ũ�ȴ�С˳��Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����H2��N2ֱ�Ӻϳɰ���N2+3H2=2NH3�����д�ʩ�϶���ʹ�ϳɰ���Ӧ���ʼӿ����:
�������¶� ������������ ������Ӧ��Ũ�� ������ѹǿ
A��ֻ���٢ڢ� B��ֻ���٢ڢ� C��ֻ���٢ۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ���ʡ���Ӧ�ȵ�����˵���д������
A��������������ʱ�������¶Ȼ�ѧ��Ӧ���ʼӿ�
B��������������ʱ������Ũ�Ȼ�ѧ��Ӧ���ʼӿ�
C����ѧ��Ӧ�ﵽ��Ӧ��ʱ����Ӧ���Ũ�����������Ũ�����
D����ѧ��Ӧ�ﵽ��Ӧ��ʱ������Ӧ���������淴Ӧ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ��л����˵������ȷ����
A. ��ϩ��ʹ������Ȼ�̼��Һ��ɫB. �Ҵ��������Na�����û���Ӧ
C. ����ʹ����KMnO4��Һ��ɫD. ��������Ա�̼��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��KCl��Na2SO4�������ʵĻ��Һ�У���֪���к�Cl��1.5mol��K+��Na+��1.5mol��Mg2+Ϊ0.5mol����SO42�������ʵ���Ϊ��������
A.1 mol
B.0.5 mol
C.0.25 mol
D.0.15 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com