
【题目】G是一种新型可降解的生物高分子材料,以丙烯(CH2=CH﹣CH3)为主要原料合成G的流程路线如图所示:
![]()
(1)聚合物G的结构简式是_____。
(2)E分子中含氧官能团的名称是_____。
(3)A转化为B的化学方程式是_____。
(4)C有多种同分异构体,写出其中能发生水解反应的有机物的结构简式_____。
【答案】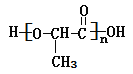 羟基、羧基 。 CH2BrCHBrCH3+2NaOH
羟基、羧基 。 CH2BrCHBrCH3+2NaOH![]() CH3CH(OH)CH2OH+2NaBr 。 CH2=CHOOCH 。
CH3CH(OH)CH2OH+2NaBr 。 CH2=CHOOCH 。
【解析】
丙烯(CH2=CH﹣CH3)与Br2发生加成反应生成A(![]() ),A强碱水溶液强碱水溶液下水解生成B(
),A强碱水溶液强碱水溶液下水解生成B(![]() ),B催化氧化生成C(
),B催化氧化生成C(![]() ),C氧化生成D(
),C氧化生成D(![]() ),D与氢气加成生成E(
),D与氢气加成生成E(![]() ),E发生缩聚反应生成G(
),E发生缩聚反应生成G(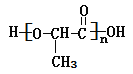 )。
)。
(1)通过以上分析知,聚合物G的结构简式是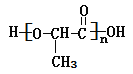 ;
;
答案: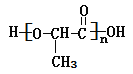 ;
;
(2)E为![]() ,E分子中含氧官能团的名称是羟基、羧基;
,E分子中含氧官能团的名称是羟基、羧基;
答案:羟基、羧基;
(3)A为CH2BrCHBrCH3,A发生水解反应生成B为CH3CH(OH)CH2OH,A转化为B的化学方程式是CH2BrCHBrCH3+2NaOH![]() CH3CH(OH)CH2OH+2NaBr;
CH3CH(OH)CH2OH+2NaBr;
答案:CH2BrCHBrCH3+2NaOH![]() CH3CH(OH)CH2OH+2NaBr。
CH3CH(OH)CH2OH+2NaBr。
(4)C有多种同分异构体,其中能发生水解反应的有机物为含有酯基,该同分异构体的结构简式为CH2=CHOOCH,
答案:CH2=CHOOCH。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有铁的氧化物样品,用150 mL 5 mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气1.68L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2CH3OH+H2O.在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是

A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时![]() 减小
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=![]() molL﹣1min﹣1
molL﹣1min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是( )
A. 元素周期表有7个周期,8个主族
B. 元素周期表有18个纵行,共16个族
C. 短周期元素中可能有副族元素
D. 在元素周期表中的金属元素和非金属元素交界处最容易找到优良的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图,下列判断中正确的是

A. 电路中电子的流动方向:adCuSO4(aq) cb
B. 该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu
C. c电极质量减少量等于d电极质量增加量
D. d电极反应:Cu2++2e = Cu,反应后CuSO4溶液浓度下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是
Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是
A. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
B. 增大c(CO),平衡正向移动,反应的平衡常数增大
C. 第二阶段,Ni(CO)4分解率较低
D. 增加Ni的含量,CO的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2 mol氨气的体积是__________, 其中含有的NH3分子数是__________,含氢原子数是_______。
(2)H2SO4的摩尔质量是________, 49g的H2SO4中含有______mol氧原子,能与______mol NaOH恰好完全反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中___________区;第二周期元素中,第一电离能比氧大的有___________种。
(2)O3可用于消毒。O3的中心原子的杂化形式为___________;其分子的 VSEPR模型为___________,与其互为等电子体的离子为___________(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为___________;C2H5OH不能用无水CaCl2千燥是因为Ca2+和C2H5OH可形成[Ca(C2H5OH)4]2+,该离子的结构式可表示为______________________。
(4)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O。

①FeO立方晶胞结构如图1所示,则Fe2+的配位数为___________;与O2-紧邻的所有Fe2+构成的几何构型为___________。
②Cu2O立方晶胞结构如图2所示,若O2-与Cu+之间最近距离为a pm,则该晶体的密度为___________g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员将Cu与Cu2O的混合物ag,用足量的稀H2SO4充分反应后,剩余固体质量为bg。
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)混合物中n(Cu2O)=________mol(用含a、b的最简式表示)
(2)若将ag混合物在空气中加热生成CuO,则m(CuO)=_______g(用含a、b的最简式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com