
【题目】由H、C、O、N、S、Cu等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
(1)基态Cu原子的价电子有____种运动状态,未成对电子占据原子轨道的形状为______。
(2)碳和氢形成的最简单碳正离子CH3+,其中心原子碳原子的杂化类型为___________,该阳离子的空间构型为___________。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________________________________。
(4)向盛有CuSO4溶液的试管中滴加少量氨水,现象是_____,离子反应方程式为____;继续滴加氨水至过量得到深蓝色溶液。经测定深蓝色是由于存在[Cu(NH3)4]SO4。其阳离子的结构式为___________,中心原子的配位数为___________。
(5)金属晶体铜的晶胞如图所示。其堆积模型是___________,铜原子间的最短距离为apm,密度为ρg·cm-3,NA为阿伏加德罗常数。铜的相对原子质量为___________(用a、ρ、NA表示,写出计算式即可)。

【答案】11 球型 sp2 平面三角形 Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO 产生蓝色沉淀 Cu2++ 2NH3·H2O= Cu(OH)2↓+2NH4+  4 面心立方最密堆积 ρNA(
4 面心立方最密堆积 ρNA(![]() a×10—10)3/4
a×10—10)3/4
【解析】
(1)基态Cu原子的价电子排布式为3d104s1;
(2)最简单碳正离子CH3+离子中C原子的价层电子对数为3,孤对电子数为0;
(3)轨道中电子排布达到全满、半满、全空时原子最稳定,Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9;
(4)向硫酸铜中滴加少量氨水,反应生成氢氧化铜蓝色沉淀;[Cu(NH3)4]2+中Cu2+与4个NH3分子通过配位键形成平面结构;
(5)根据m =ρV=4M(Cu)/NA计算可得。
(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为1s22s22p6
3s23p63d104s1,价电子排布式为3d104s1,则价电子有11种运动状态,未成对电子占据原子轨道为4s,形状为球型,故答案为:11;球型;
(2)最简单碳正离子CH3+离子中C原子的价层电子对数为3,则碳原子的杂化类型为sp2杂化,孤对电子数为0,CH3+离子的空间构型为平面三角形,故答案为:sp2;平面三角形;
(3)轨道中电子排布达到全满、半满、全空时原子最稳定,Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO,故答案为:Cu+的最外层电子排布为3d10,而Cu2+的最外层电子排布为3d9,因最外层电子排布达到全满时稳定,所以固态Cu2O稳定性强于CuO;
(4)向硫酸铜中滴加少量氨水,反应生成氢氧化铜蓝色沉淀,反应的离子方程式为:Cu2++ 2NH3·H2O= Cu(OH)2↓+2NH4+;[Cu(NH3)4]SO4的阳离子为[Cu(NH3)4]2+,[Cu(NH3)4]2+中Cu2+与4个NH3分子通过配位键形成平面结构,结构式为 ,故答案为:产生蓝色沉淀;Cu2++ 2NH3·H2O= Cu(OH)2↓+2NH4+;
,故答案为:产生蓝色沉淀;Cu2++ 2NH3·H2O= Cu(OH)2↓+2NH4+; ;4;
;4;
(5)根据Cu晶体的晶胞结构示意图可知,堆积模型是面心立方最密堆积,以顶点铜原子为例,距离最近的铜原子位于晶胞的面心上,这样的原子有12个,所以晶胞中Cu原子的配位数为12,Cu晶体的晶胞中含有铜原子数为8×1/8+6×1/2=4,根据m =ρV=4M(Cu)/NA可得ρ(![]() a×10—10)3=4M(Cu)/NA,M(Cu)=ρNA(
a×10—10)3=4M(Cu)/NA,M(Cu)=ρNA(![]() a×10—10)3/4,故答案为:面心立方最密堆积;ρNA(
a×10—10)3/4,故答案为:面心立方最密堆积;ρNA(![]() a×10—10)3/4。
a×10—10)3/4。


科目:高中化学 来源: 题型:
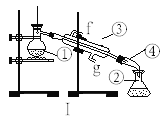
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同)
(2)从碘水中分离出I2,选择装置_________,该分离方法的名称为___________。
(3)装置A中①的水的进出方向是_________,
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去CaO中少量CaCO3__________;
(5)回收碘的CCl4溶液中的CCl4__________。
(6)除去Ca(OH)2溶液中悬浮的CaCO3__________;
(7)除去NaCl中所含的少量KNO3___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.金属元素与非金属元素只能形成离子化合物
B.离子化合物中的阳离子都是金属离子
C.含离子键的化合物肯定是离子化合物
D.溶于水后可以导电的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在______ molAl2(SO4)3中含0.3 mol SO42–,含Al3+约_______________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为_________,密度之比为_________。
(3)质量同为46 g的两种气体,NO2和N2O4,物质的量之比为________,二者所含O原子个数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。

下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程) 。
(2)X与金属钠反应放出氢气,反应的化学方程式是 。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收下层液体;
F.从分液漏斗口倒出上层水溶液;
G.将漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准漏斗上的小孔;
H.静置、分层。
(1)上述E步骤的操作中应注意:________。
(2)上述G步骤的操作的目的是:________。
(3)能用CCl4从碘水中萃取碘的原因是_____。
(4)若利用装置I分离四氯化碳和碘的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为:_____,仪器③和④的名称:③______④______;现需配制250ml0.2 mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是_______ ,________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com