

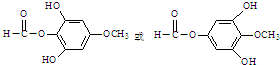
 ,
, .
.


科目:高中化学 来源: 题型:
| A、酸性条件下,用H2O2将I-转化为I2:H2O2+2I-═I2+2OH- |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、氨水溶解氯化银固体:AgCl+2 NH3?H2O═[Ag(NH3)2]++Cl-+2H2O |
| D、用饱和纯碱溶液洗涤试管中残留的苯酚:CO32-+2C6H5OH→2C6H5O-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )| A、T°C时,该反应的平衡常数值为4 |
| B、c点没有达到平衡,此时反应向逆向进行 |
| C、若c点为平衡点,则此时容器内的温度高于T°C |
| D、T°C时,直线cd上的点均为平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3: | 有白色沉淀产生,说明样品中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| B、把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol?L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 |
| C、将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol |
D、 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | 检验试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com