
| A.最外层有6个电子 |
| B.位于元素周期表的第七周期 |
| C.主要化合价为-4价、+4价 |
| D.电解硝酸铜与硝酸“类铅”的混合溶液时首先会析出“类铅” |
科目:高中化学 来源:不详 题型:单选题
| A.只有① | B.②⑤⑦ | C.①⑥ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。
数与电子层数相同。最高价氧化物与强酸反应的离子方程式为________________________________(2分),最高价氧化物对应水化物与氢氧化钾反应的化学方程式为 _________________________________________(2分)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe:1s22s22p63s23p63d54s3 | B.F ˉ:1s22s22p6 |
| C.K:1s22s22p63s23p64s1 | D.Kr:1s22s22p63s23p63d104s24p6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 数之和还多1。
数之和还多1。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
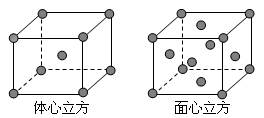
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
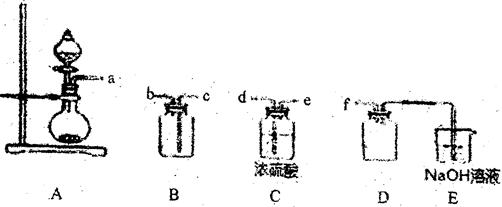
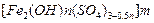 ,广泛用于污水处理。
,广泛用于污水处理。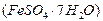 的过程如下:
的过程如下: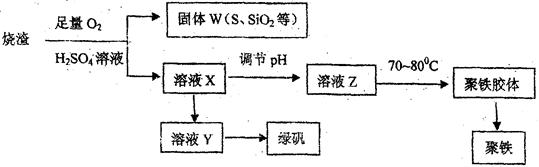
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com