
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.如果反应前充入由18O原子组成的O2,反应达到平衡状态时, 18O在所有物质中都存在
C.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
D.在工业合成SO3时,只需要考虑反应速率的问题
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、CO32-
B. 0.1 mol·L-1Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C. 0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.  =1×1014的溶液:Ca2+、Na+、ClO-、NO3-
=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池的总反应为:2CH3OH +3O2= 2CO2 ↑+ 4H2O,下图是该电池的示意图。下列说法正确的是
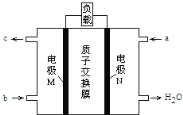
A.a 是氧气,b 是甲醇
B.质子从 N 电极区穿过质子交换膜移向 M 电极区
C.正极反应为:O2 +2H2O + 4e- = 4 OH-
D.当电路中有 3 mole- 转移时,电池中n(H+)变化为 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为 ,B分子中的官能团名称为 。
(2)反应⑦中物质X的分子式为 ,反应⑧的类型为 。
(3)反应⑤的化学方程式为 。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是 。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为 。
(5)检验反应①进行程度,需要的试剂有_________________。
A.新制的Cu(OH)2悬浊液
B.碘水
C.NaOH溶液
D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6。分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498

若生成1 mol P4O6,则反应P4(白磷)+3O2===P4O6中的能量变化为
A.吸收1 638 kJ能量
B.放出126 kJ能量
C.吸收126 kJ能量
D.放出1 638 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NO的说法正确的是( )
A.NO是红棕色气体
B.常温下氮气与氧气反应可生成NO
C.NO溶于水可以生成硝酸
D.NO是汽车尾气的有毒成分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
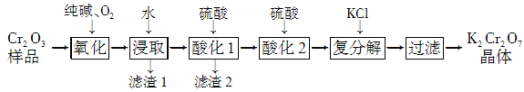
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com