
【题目】环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一.请运用化学反应原理知识,回答下列问题:.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知: ①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(1)△H1=﹣662kJmol﹣1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2O(1)△H2=﹣1251kJmol﹣1
据此,写出CH4将NO2还原为N2的热化学方程式:
(2)用活性炭还原法也可处理氮氧化物.有关反应为:C(s)+2NO(g)N2 (g)+CO2 (g)某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol. ①0min~10min内以v(NO)表示的平均化学反应速率为 .
②下列各项能判断该反应达到平衡状态的是 .
A.容器内压强保持不变
B.速率关系:2v(NO)(正)=v (N2)(逆)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
③在相同条件下,若在容器中放人生石灰,则NO的平衡转化率(填“增大”、“不变”或“减小”).
【答案】
(1)CH4(g)+2NO2(g)=N2(g)+2H2O(l)△H=﹣956.5KJ/mol
(2)CD ;0.006mol/(L?min);增大
【解析】解:(1)①CH4 (g)+4NO2 (g)═4NO(g)+CO2 (g)+2H2O(1)△H1=﹣662kJmol﹣1
②CH4 (g)+4NO(g)═2N2 (g)+CO2 (g)+2H2O(1)△H2=﹣1251kJmol﹣1
据盖斯定律①+②得到CH4将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=N2(g)+2H2O(l)△H=﹣956.5KJ/mol;
所以答案是:CH4(g)+2NO2(g)=N2(g)+2H2O(l)△H=﹣956.5KJ/mol;(2)
C(s)+ | 2NO(g) | N2 (g)+ | CO2 (g) | |
起始(mol) | 0.3 | 0 | 0 | |
转化(mol) | 0.18 | 0.09 | 0.09 | |
平衡(mol) | 0.12 | 0.09 | 0.09 |
①0min~10min内以v(NO)表示的平均化学反应速率= ![]() =0.006mol/(Lmin),所以答案是:0.006mol/(Lmin);
=0.006mol/(Lmin),所以答案是:0.006mol/(Lmin);
②反应是气体体积不变的反应,
A.反应前后气体物质的量不变,压强不变,容器内压强保持不变不能说明反应达到平衡状态,故A错误;
B.速率关系:若v(NO)(正)=2v (N2)(逆),证明氮气的正逆反应速率相同,证明达到平衡状态,但2v(NO)(正)=v (N2)(逆)不能说明反应达到平衡状态,故B错误;
C.容器内CO2的体积分数不变是平衡的标志,故C正确;
D.反应前后气体体积不变,气体质量分数变化,若混合气体的密度保持不变,能证明反应达到平衡状态,故D正确;
所以答案是:CD;
③在相同条件下,若在容器中放人生石灰,CaO+CO2=CaCO3,平衡正向进行,一氧化氮转化率增大,则NO的平衡转化率增大,所以答案是:增大.
【考点精析】根据题目的已知条件,利用化学平衡状态的判断和化学平衡的计算的相关知识可以得到问题的答案,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Na+、Fe2+、NO3﹣、SO42﹣
B.滴入酚酞试液显红色的溶液中:K+、Fe3+、ClO﹣、SO42﹣
C.![]() =1×1012的溶液中:NH4+、Cl﹣、NO3﹣、Al3+
=1×1012的溶液中:NH4+、Cl﹣、NO3﹣、Al3+
D.由水电离出的c(H+)=1×10﹣12mol/L的溶液中:Na+、K+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.短周期是指第1、2周期
B.过渡元素全部是金属元素
C.IA族的元素全部是金属元素
D.元素周期表有8个副族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号) , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) .
(2)判断滴定终点的现象是: .
(3)如图是某次滴定时的滴定管中的液面,其读数为mL. ![]()
(4)根据下列数据:请计算待测盐酸溶液的浓度:mol/L.
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1molL﹣1 . 醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度I随加入氨水的体积(V)变化的曲线关系是图中的( )
A.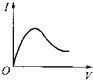
B.
C.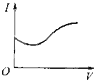
D.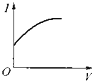
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
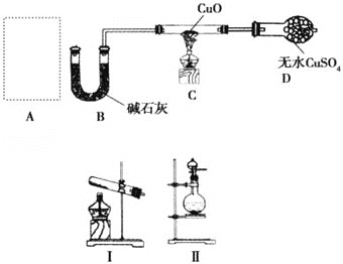
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com