
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
分析 A.甲烷分子中含有4个碳氢键,16g甲烷的物质的量为1mol,含有4mol碳氢键;
B.缺少溶液体积,无法计算溶液中钠离子数目;
C.氯化氢为强电解质,在溶液中完全电离;
D.1mol氯气与铁完全反应最多得到2mol电子.
解答 解:A.16g甲烷的物质的量为:$\frac{16g}{16g/mol}$=1mol,1mol甲烷分子中含有4mol碳氢键,含有4NA个C-H键,故A正确;
B.没有告诉溶液体积,无法计算溶液中钠离子数目,故B错误;
C.氯化氢为强电解质,在溶液中完全电离出氢离子和氯离子,则溶液中不存在氯化氢分子,故C错误;
D.1mol氯气与铁反应生成氯化铁,最多得到2mol电子,转移电子总数为2NA个,故D正确;
故选AD.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,B、C为易错点,注意B中缺少溶液体积、C中氯化氢为强电解质,溶液中不存在溶质分子.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
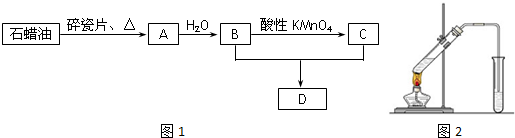
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2$\stackrel{浓硫酸}{→}$ +HO-NO2$\stackrel{浓硫酸}{→}$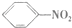 +H2O +H2O | D. | 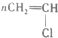 $\stackrel{引发剂}{→}$ $\stackrel{引发剂}{→}$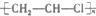 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

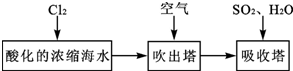
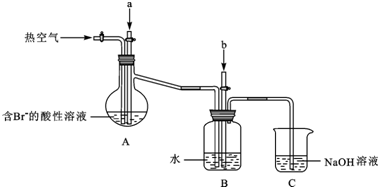
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
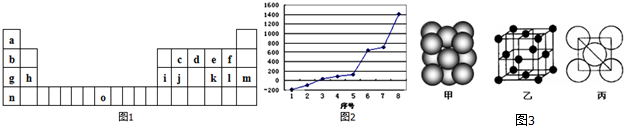
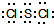 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要点燃后才能发生反应,所以这个反应为吸热反应 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com