
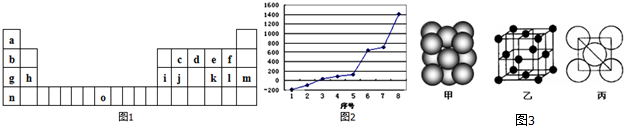
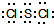 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于分析 (1)o为Fe,原子核外电子数为26,据此确定元素在周期表中的位置;
(2)第三周期8种元素按单质熔点最高的为原子晶体Si,第三周期中电负性最大的为氯元素;
(3)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,SiC晶体与晶体Si都是原子晶体,根据Si-C与Si-Si键能大小分析解答晶体熔点高低;
(4)k与l形成的化合物SCl2,硫原子与氯原子之间形成一对共用电子对,根据SCl2的物理性质要判断晶体类型;
(5)该类型为面心立方最密堆积,配位数=3×$\frac{1}{2}$×8=12;根据$ρ=\frac{m}{V}$计算密度.
解答 解:(1)o为Fe,原子核外电子数为26,位于周期表中第四周期 第 VIII族,
故答案为:Fe;第四周期 第 VIII族;
(2)序号“8”单质的熔点最高,第三周期8种元素单质熔点最高的为原子晶体Si,第三周期中电负性最大的为氯元素,单质常温下为气体,其沸点高于氩气,所以选 2,
故答案为:Si;2;
(3)j为Si,c为C,二者以1:1相互交替结合而形成的晶体为SiC,因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高,
故答案为:SiC;SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,C-Si键的键能大,因而SiC的熔沸点高;
(4)k与l形成的化合物SCl2,硫原子与氯原子之间形成一对共用电子对,其电子式为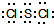 ,根据SCl2的熔点较低,所以是分子晶体,
,根据SCl2的熔点较低,所以是分子晶体,
故答案为: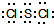 ;分子;
;分子;
(5)根据图片知,Al单质为面心立方最密堆积,Al原子配位数配位数=3×$\frac{1}{2}$×8=12,由图3乙可知占据顶点和面心,则个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Al的原子半径为d,则晶胞的边长为4d×$\frac{\sqrt{2}}{2}$cm=$2\sqrt{2}d$cm,所以晶胞的体积为($2\sqrt{2}d$)3cm3,根据$ρ=\frac{m}{V}$可知,该晶胞的密度为$\frac{\frac{4M}{{N}_{A}}}{(2\sqrt{2}d)^{3}}$=$\frac{M}{4\sqrt{2}{N}_{A}{d}^{3}}$,
故答案为:12;4;$\frac{M}{4\sqrt{2}{N}_{A}{d}^{3}}$.
点评 本题考查物质结构与性质,涉及元素周期表、电子式、分子结构与性质、晶体类型与性质、晶胞的计算等,难度中等,侧重考查学生对知识运用、分析解决问题能力.


科目:高中化学 来源: 题型:解答题
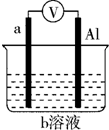 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
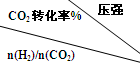 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 16g CH4中含有4NA个C-H键 | |
| B. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| C. | 1 L 0.1 mol•L-1盐酸含有0.1NA个HCl分子 | |
| D. | 1mol Cl2与足量的铁反应,转移的电子总数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
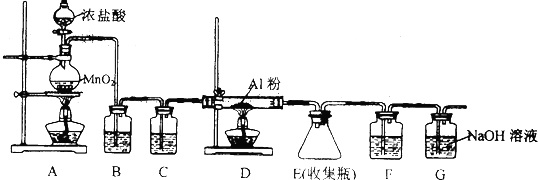
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com