
A、O原子的轨道表示式为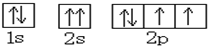 |
B、H2O的电子式为 |
| C、Ca原子的电子排布式为 1s22s22p63s23p63d2 |
D、K原子的原子结构示意图为 |
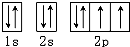 ,故A错误;
,故A错误; ,故B正确;
,故B正确; ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
| A、最外层有5个电子的原子都是非金属原子 |
| B、M层电子数为奇数的主族元素的族序数与该元素原子的M层电子数不一定相等 |
| C、同一主族的两种元素的原子序数之差可能是44 |
| D、第Ⅷ族包含了8、9、10三列,故所有族中第Ⅷ族元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜片置于盐酸中 |
| B、将锌片置于MgCl2溶液中 |
| C、将铁片置于CuSO4中 |
| D、Na2CO3溶液与CaCl2溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、拆开2molH2(g)和1 molO2(g)中的化学键成为H、O原子,共放出1368 kJ能量 |
| B、由H、O原子形成2 molH2O(g),共吸收1852 kJ能量 |
| C、拆开2molH2O(g)中的化学键成为H、O原子,共吸收1852 kJ能量 |
| D、2 molH2(g)和1 molO2(g)反应生成2 molH2O(g),共吸收484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、C>A>B>D |
| B、C>D>A>B |
| C、A>C>B>D |
| D、C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点:NH3>PH3>AsH3 |
| B、熔点:Li>Na>K |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、等物质的量的Na2CO3和CH3COOH两种溶液混合,一定 有:c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-) |
| B、常温下,已知酸H2A存在如下平衡:H2A?H++HA-;HA-?H++A2-(Ka1=5.9xl0-2,Ka2=6.4xl0'6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 |
| C、相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c (Na+)>c (ClO-)>c (CH3COO-)>c (OH-)>c (H+) |
| D、常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,此时溶液pH=5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com