
| A. | 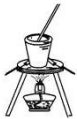 将海带灼烧成灰 将海带灼烧成灰 | B. | 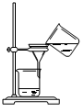 过滤得含I-的溶液 过滤得含I-的溶液 | ||
| C. | 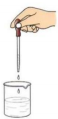 向滤液中加稀H2SO4和H2O2溶液 向滤液中加稀H2SO4和H2O2溶液 | D. | 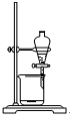 加入CCl4,萃取 加入CCl4,萃取 |
分析 A.固体的灼烧在坩埚中进行;
B.过滤操作时应用玻璃棒引流;
C.双氧水将碘离子氧化成碘单质,胶头滴管不能插入烧杯中;
D.四氯化碳的密度比水大,有机层从分液漏斗下口放出.
解答 解:A.灼烧海带可以在坩埚中进行,该操作方法合理,故A不选;
B.过滤应用玻璃棒引流,防止浊液外漏,该操作方法错误,故B选;
C.过氧化氢具有强氧化性,可氧化碘离子生成碘单质,图示操作方法合理,故C不选;
D.溶有碘单质的四氯化碳溶液在下层,需要从下层分离出有机层,图示操作合理,故D不选;
故选B.
点评 本题考查了化学实验方案的设计与评价,题目难度不大,明确海带中提取碘的步骤及正确操作方法为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
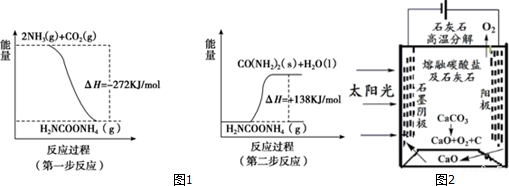
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:①X元素原子价电子排布式为ns2np3,且原子半径是同族元素中最小的.②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子.③Z元素的电离能数据如表(kJ/mol):| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
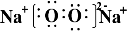 ,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、
,含有的化学键类型为离子键、非极性键,Z2Y2为离子晶体、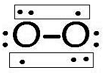 ,其分子空间构型为直线型.
,其分子空间构型为直线型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应/K/温度 | 458K 478K 488K |
| ① ② ③ | 1.78×104 1.43×104 1.29×104 1.91×107 1.58×107 1.45×107 8.11×108 3.12×108 2.00×108 |
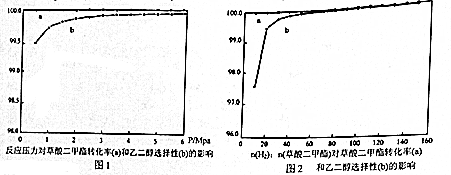
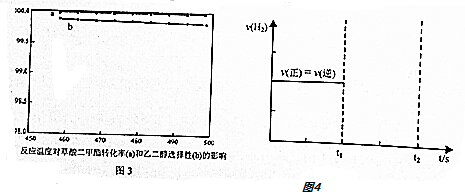
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量ZnCl2固体 | B. | 加入少量CuSO4固体 | ||
| C. | 加入少量水 | D. | 用98%的浓硫酸代替稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验操作示意图 | 实验现象 |
| Ⅰ | 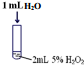 | 有极少量气泡产生 |
| Ⅱ | 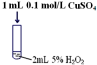 | 产生气泡速率略有加快 |
| Ⅲ | 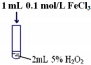 | 产生气泡速率明显加快 |
| t/min | 0 | 2 | 3 | 6 | 8 | 10 |
| v(O2)mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中每生成1mol N2O,消耗67.2LCO | |
| B. | 等质量的N2O和CO2含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | 上述反应中若有3 mol的CO被还原,则转移6NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com