
【题目】酯类是工业上重要的有机原料,具有广泛用途。
乙酸苯甲酯(![]() )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业。乙酸苯甲酯的合成路线如下:
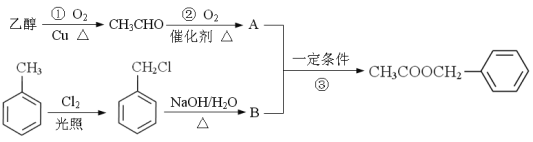
已知:R-Cl![]() R-OH , R- 为烃基)
R-OH , R- 为烃基)
(1)A的结构简式为 ,B所含官能团的名称是 ;
反应③的类型是 。
(2)下列物质中能与A的水溶液反应的是 。(填序号)
A.CaCO3 B.NaOH C.CuSO4 D.NaCl E.Zn
任写一个以上能与A的水溶液反应的化学方程式 。
![]() (3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(3)下列转化中 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
A.乙醇制取乙醛
B.由![]() 制备
制备
C.2CH3CHO + O2![]() 2A
2A
(4)写出反应①的化学反应方程式 。
反应①的反应类型是 。
【答案】(1)CH3COOH ,羟基,酯化反应(或取代反应)
(2)ABE CH3COOH+NaOH![]() CH3COONa + H2O(三个方程式任写一个)
CH3COONa + H2O(三个方程式任写一个)
(3)C
(4)2CH3CH2OH + O2![]() 2CH3CHO + 2H2O 氧化反应
2CH3CHO + 2H2O 氧化反应
【解析】
试题分析:乙醇发生催化氧化生成乙醛,乙醛进一步发生氧化反应生成A为CH3COOH,甲苯与氯气发生取代反应生成![]() ,发生水解反应生成B为
,发生水解反应生成B为![]() ,乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯(
,乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯(![]() )。(1)有上述分析可知,A的结构简式为CH3COOH,B为
)。(1)有上述分析可知,A的结构简式为CH3COOH,B为![]() ,含有官能团为羟基,反应③是酯化反应,也属于取代反应,故答案为:CH3COOH;羟基;酯化反应或取代反应;
,含有官能团为羟基,反应③是酯化反应,也属于取代反应,故答案为:CH3COOH;羟基;酯化反应或取代反应;
(2)A为CH3COOH,含有羧基,酸性比碳酸强,能与碳酸钙、氢氧化钠和锌反应,不能与硫酸铜、NaCl反应,乙酸和氢氧化钠反应的方程式为:CH3COOH+NaOH=CH3COONa + H2O;(3)下列物质中与甲苯(![]() )互为同系物,含有1个苯环,若有侧链为烷基,相差若干个CH2原子团,故与之互为同系物的是
)互为同系物,含有1个苯环,若有侧链为烷基,相差若干个CH2原子团,故与之互为同系物的是![]() 、
、 ,故答案为:ad;
,故答案为:ad;
(4)a.乙醇制取乙醛,有水生成,原子的理论利用率不是100%,故a不符合;
b.甲苯制备![]() ,有HCl生成,原子的理论利用率不是100%,故b不符合;
,有HCl生成,原子的理论利用率不是100%,故b不符合;
c.2CH3CHO+H2![]() 2A,属于加成反应,原子的理论利用率为100%,符合绿色化学的要求,故c符合。(4)反应①为乙醇的催化氧化生成乙醛,方程式为:2CH3CH2OH + O2
2A,属于加成反应,原子的理论利用率为100%,符合绿色化学的要求,故c符合。(4)反应①为乙醇的催化氧化生成乙醛,方程式为:2CH3CH2OH + O2 ![]() 2CH3CHO + 2H2O。
2CH3CHO + 2H2O。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH![]() (CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如下表:
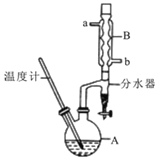

①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应 (填“上”或“下”)口倒出。
(4)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(6)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子能在溶液中大量共存的是:( )
A.Na+、NH、CO、Br-
B.Fe2+、H+、NO、Cl-
C.Al3+、Ca2+、HCO、SO
D.Fe3+、Cu2+、NO、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为 ,负极反应式为 ;正极材料为 ,正极反应式为 。

(2)在下列事实中,各是什么因素影响了化学反应速率?请填写对应序号:
A.催化剂 B.反应物的性质
C.反应温度 D.反应物的浓度
①同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢:
②同样大小的石灰石分别与0.1 mol·L-1的盐酸和1 mol·L-1的盐酸反应,速率不同:
③夏天食品容易变质,而冬天不易发生该现象:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
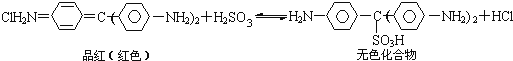
下列说法正确的是
A.品红溶液中同时通入Cl2、SO2,漂白效果会更好
B.加热不能判断品红褪色是通入SO2还是通入Cl2引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.品红分子结构中,19个碳原子都可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第___________周期,___________族,属于金属元素还是非金属元素? ___________。
(2)该原子核内中子数为___________;
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________;
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
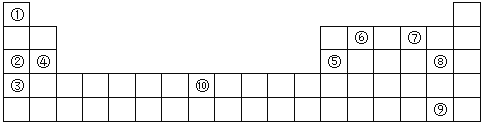
(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________(填化学式)。
(2)10种元素中,原子半径最小的是___________(填序号)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为___________;
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________;
(5)元素⑩的原子序数为___________,其单质与⑦的氢化物高温下反应的化学方程式为___________;
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为___________色。
(Ⅲ)判断以下叙述正确的是___________
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
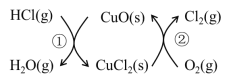
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
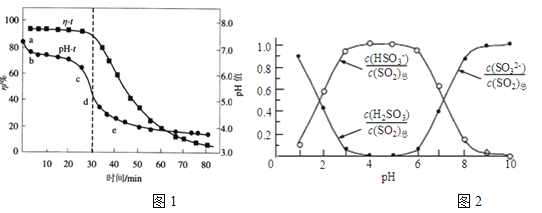
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
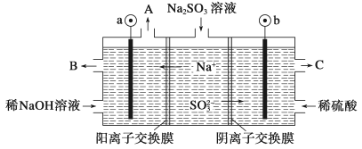
b极的电极反应式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com