
【题目】铜是人类最早发现并广泛使用的一种金属。回答下列问题:
(1)CuFeS2是其中铜的主要存在形式。CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是 _______。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是____,中心原子杂化类型为____。
②X的沸点比水低的主要原因是___________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知 [Cu(NH3)4]2+的空间构型是________。
(4)某镍白铜合金的立方晶胞结构如图所示。
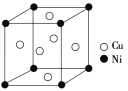
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为d g·cm-3,晶胞参数a=________nm。(设NA代表阿伏加德罗常数)
【答案】离子键 硫(S) V形 sp3 水分子间存在氢键 NH3 极性 平面正方形 3∶1 ![]()
【解析】
(1)根据非金属元素和金属元素的性质,判断形成的化学键的类型;非金属性越强,电负性越大;
(2)根据臭鸡蛋气味的气体X产生,则X为H2S,根据H2S的结构特点进行分析;根据氢键的性质解答;
(3) [Cu(NH3)4]2+中的结构特点和相似相溶原理金相分析解答;因为存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;
(4)①由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法判断每个晶胞中含有Cu原子的个数和Ni原子的个数; 根据m=ρV可得,计算1 mol晶胞的质量,进而求解。
(1)CuFeS2中硫为非金属元素,铁和铜为金属元素之间形成的化学键为离子键;非金属性越强,电负性越大,故S的电负性最大,故答案为:离子键;S;
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生,则X为H2S。
①S原子形成2个S-H键,含有2对孤电子对,杂化轨道数目为4,S原子采取sp3杂化,分子空间构型为V形结构,分子中正负电荷重心不重合,属于极性分子1,故答案为:V形;sp3;极性;
②H2S的沸点比水低的主要原因是:水分子间形成氢键,故答案为:水分子间存在氢键;
(3) [Cu(NH3)4]2+中,铜离子提供空轨道,氨气分子中的氮元素提供孤电子对;Cu(NH3)2Cl2的同分异构体可溶于水,根据相似相溶原理,水是极性分子,所以该分子应该为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型应该是平面正方形;故答案为:NH3;极性;平面正方形;
(4)①由晶胞结构图可知,Ni原子处于立方晶胞的顶点,Cu原子处于立方晶胞的面心,根据均摊法,每个晶胞中含有Cu原子的个数为6×![]() =3,含有Ni原子的个数为8×
=3,含有Ni原子的个数为8×![]() =1,故晶胞中Cu原子与Ni原子的数量比为3∶1,故答案为:3∶1;
=1,故晶胞中Cu原子与Ni原子的数量比为3∶1,故答案为:3∶1;
②根据m=ρV可得,1 mol晶胞的质量为(64×3+59)g=a3×d g·cm-3×NA,则a=![]() cm=
cm=![]() nm,故答案为:
nm,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 电解饱和食盐水可制取烧碱、氯气、氢气
B. 从海水中可提取镁、溴、碘等物质
C. 粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+
D. 在镀件上镀铜,镀件作阴极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅藻土是由无定形SiO2组成的,含有少量Fe2O3、Al2O3及有机物等杂质,通常呈浅黄色或浅灰色,质软多孔。工业上可按如图所示流程,用硅藻土制备纳 米级二氧化硅。
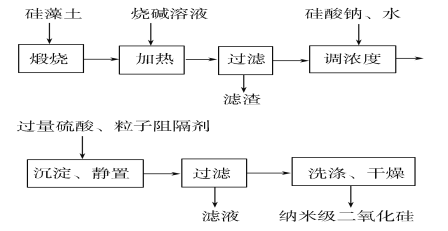
请回答下列问题:
(1)煅烧硅藻土的目的是___________。
(2)在加热条件下加入烧碱溶液时,发生反应的化学方程式为___________、__________。
(3)加入过量硫酸后,生成沉淀的离子方程式为_________。
(4)若用纳米级二氧化硅制成水溶液,则该溶液所具有的性质与下列图片有关的是________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备乙酸、钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为______;
②检验TiO2·x H2O中Cl-是否被除净的方法是___________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
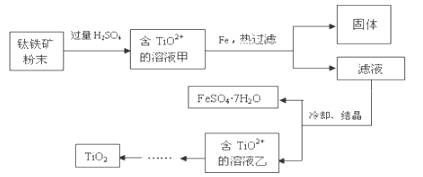
(2)溶液甲中加入Fe的作用是__________
(3)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是__________
Ⅱ.二氧化钛的用途:
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
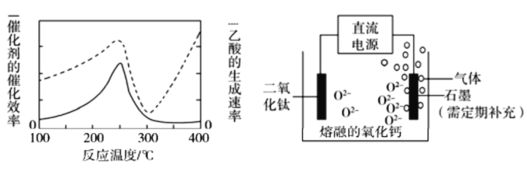
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示(实线表示的是催化剂的催化效率,虚线表示的是乙酸的生成速率),250~300 ℃时,温度升高而乙酸的生成速率降低的原因是______。
(5)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氧化钙,原理如图所示,二氧化钛电极连接电源_____(填“正极”或“负极”),该极电极反应式为__________。石墨极上石墨参与反应产生的气体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。
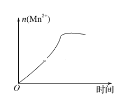
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含 T 的盐溶液一定能电离出 T 的阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com