
| A. | △H>0,△H-T△S<0 | B. | △H<0,△H-T△S>0 | C. | △H>0,△H-T△S>0 | D. | △H<0,△H-T△S<0 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
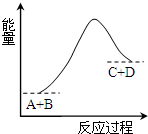
| A. | 该反应反应物A的能量大于生成物D的能量 | |
| B. | 该反应为吸热反应 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B表示的反应速率是0.3 mol/(L•min) | |
| C. | 2 min末时的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 用D表示的反应速率为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
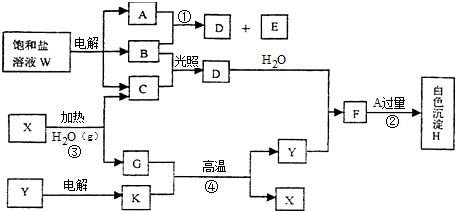
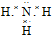 ,B的晶体类型是分子晶体.
,B的晶体类型是分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
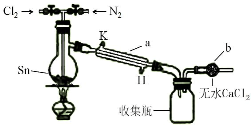 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.| 实验内容 | 实验现象 | 结论 |
| 实验1:滴入KI溶液,再加淀粉溶液 | 溶液最终变为蓝色 | 产品中含有Cl2 |
| 实验2:① | ② | |
| 实验3:③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
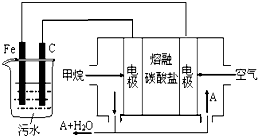
| A. | Fe为阳极,其电极反应为:Fe-3e-+3OH-=Fe(OH)3↓ | |
| B. | 通入甲烷的电极为负极,其电极反应为:CH4-8e-+10OH-=CO32-+7H2O | |
| C. | 为了使该燃料电池长时间稳定运行,电池工作时必须 有部分A物质参加循环.A物质是CO2 | |
| D. | 实验过程中,若在阴极产生了4.48 L气体,则电路中通过的电子个数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯常温下是气体,聚乙烯常温下是固体 | |
| B. | 苯可做有机溶剂 | |
| C. | 乙醇和乙烯都能发生加成反应 | |
| D. | 油脂可用来制造肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 在反应3Cl2+8NH3═6NH4Cl+N2中,有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g | |
| D. | 等物质的量的CH4和CO所含分子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com