
①R-X+H2O![]() R-OH+HX(R表示烃基,X表示卤原子).
R-OH+HX(R表示烃基,X表示卤原子).
②有机物分子中的硝基可转变成氨基:
R-NO2+Fe+HCl![]() R-NH2+FeCl2+H2O(未配平)
R-NH2+FeCl2+H2O(未配平)
“对乙酰胺基酚”俗称“扑热息痛”,为白色晶体,具有解热镇痛药效.扑热息痛的一种生产流程如下:
![]()

(1)写出反应②、⑤的化学方程式:
反应②_____________________________________________.
反应⑤_____________________________________________.
(2)有人认为上述流程反应②应当放在反应③后进行,你认为是否合理,说明理由:
____________________________________________________
(3)对扑热息痛的下列说法中正确的是(选填序号)__________.
a.在溶液中,1 mol扑热息痛最多与1 mol NaOH反应
b.能与浓溴水反应使溴水褪色
c.在其分子中含有肽键
d.遇氯化铁溶液发生显色反应
(4)写出与扑热息痛互为同分异构体,且分子中含有苯环的a —氨基酸的结构简式:_____.
| 设计意图:本题是对化学平衡知识的综合考查,着重考查了学生根据题中信息并结合已学知识进行分析、归纳和推理的能力,反映了学生思维的深刻性与敏捷性.
解析:(1)依题意知钠与氯化钾的反应为可逆反应,即Na(l)+KCl(l) (2)根据平衡移动原理,结合题中的可逆反应可知:降低压强或升高温度或及时移去钾蒸气,均能使平衡向右移动而提高原料利用率.但温度过高会使钠也变成蒸气逸出,故常压下只能在770 ℃~890 ℃的范围内升高温度. (3)当反应温度升至900 ℃时,金属钠也转变为蒸气,结合题中信息〔Kc=c(K),即平衡常数只与气态物质的浓度有关〕可知,此时反应的平衡常数可表示为:Kc= 易错点:因思维的灵活性较差,不能从实际情况推断出“钾变成蒸气逸出,而钠不能变成蒸气”的结论,导致回答失误;忽略题中所给平衡常数的信息,而是机械地把平衡常数表达式写为:Kc= 答案:(1)770℃;890℃ (2)降低压强或移去钾蒸气,适当升高温度 (3)
|


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| R | 580 | 1800 | 2700 | 11600 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R、Q六种短周期元素原子序数依次增大,Y、R、Q三种元素在周期表中相对位置如下:
请填写下列空白:
(1)若Y与Q形成的液体化合物是常见的重要有机溶剂。则Y、Q两种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示以下同) 。
(2)若化合物WQ是海水中的主要成分。等浓度的WQ与NH4Cl的混合液,其离子浓度由大到小的顺序为 。
(3)若Z、R是同一主族元素且X、Z、R位于不同周期。写出均含X、W、Z、R四种元素的两种化合物相互间发反应生成气体的离子方程式: 。
(4)若A是Y元素组成的单质,能发生如右图所示转化,工业上通过在高温下置换反应c制取非金属单质D,C是Z和Y的化合物,B、D在现代信息技术上有着重要用途。则反应c的化学方程式: 。
(5)由X、Y两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成水蒸气时所释放的能量为50.125kJ,已知H2O(l)= H2O(g), ΔH = +44 kJ/mol
请写出表示其燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)以工业废铁屑为原料生产氧化铁红颜料并进行适当的综合利用,其主要流程如下:
已知:FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的悬浊液。
请回答下列问题:
(1)用5 % 的Na2CO3热溶液去油污(主要成分是油脂)时,反应生成的有机产物是(写名称): 。
(2)反应Ⅰ需要控制在50 ℃~80 ℃以提高反应速率,如果硫酸过量,反应混合液与空气接触会发生副反应,如何检验副反应的产物?
。
(3)写出在空气中煅烧沉淀的化学反应方程式: 。
(4)本流程中产生的CO2和H2,在催化剂作用下按体积比1∶1合成一种重要的有机化工原料R,该合成符合绿色化学要求。上述合成反应∆H=+14.9 kJ/mol,则加压、降温可以使平衡分别向 、 方向移动。已知液体R的燃烧热为254.6 kJ/mol,则R完全燃烧的热化学方程式为 。
(5)摩尔盐常用于定量分析并用于医药、电镀方面。已知摩尔盐中结晶水的含量为27.6 %,n(Fe2+)∶n(SO2-4 )=1∶2,则摩尔盐的化学式中,结晶水数目x的计算式为:
x= 。
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江省大庆市第三十五中学高三期中考试化学试卷(带解析) 题型:填空题
X、Y、Z、W、R、Q六种短周期元素原子序数依次增大,Y、R、Q三种元素在周期表中相对位置如下: 
请填写下列空白:
(1)若Y与Q形成的液体化合物是常见的重要有机溶剂。则Y、Q两种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示以下同) 。
(2)若化合物WQ是海水中的主要成分。等浓度的WQ与NH4Cl的混合液,其离子浓度由大到小的顺序为 。
(3)若Z、R是同一主族元素且X、Z、R位于不同周期。写出均含X、W、Z、R四种元素的两种化合物相互间发反应生成气体的离子方程式: 。
(4)若A是Y元素组成的单质,能发生如右图所示转化,工业上通过在高温下置换反应c制取非金属单质D,C是Z和Y的化合物,B、D在现代信息技术上有着重要用途。则反应c的化学方程式: 。
(5)由X、Y两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成水蒸气时所释放的能量为50.125kJ,已知H2O(l) = H2O(g), ΔH =" +44" kJ/mol
请写出表示其燃烧热的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一上学期期中试卷化学试卷(理) 题型:填空题
X、Y、Z、W、R、Q六种短周期元素原子序数依次增大,Y、R、Q三种元素在周期表中相对位置如下:
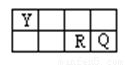
请填写下列空白:
(1)若Y与Q形成的液体化合物是常见的重要有机溶剂。则Y、Q两种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示以下同) 。
(2)若化合物WQ是海水中的主要成分。等浓度的WQ与NH4Cl的混合液,其离子浓度由大到小的顺序为 。
(3)若Z、R是同一主族元素且X、Z、R位于不同周期。写出均含X、W、Z、R四种元素的两种化合物相互间发反应生成气体的离子方程式: 。
(4)若A是Y元素组成的单质,能发生如右图所示转化,工业上通过在高温下置换反应c制取非金属单质D,C是Z和Y的化合物,B、D在现代信息技术上有着重要用途。则反应c的化学方程式: 。

(5)由X、Y两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成水蒸气时所释放的能量为50.125kJ,已知H2O(l) = H2O(g), ΔH = +44 kJ/mol
请写出表示其燃烧热的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com