
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
【答案】CO(g)+2H2(g)===CH3OH(g)△H=-90.1 kJ/mol![]() C压缩容器体积或增大体系压强SO2-2e-+2H2O==SO42-+4H+HSO3--2e-+H2O=SO42-+3H+c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)
C压缩容器体积或增大体系压强SO2-2e-+2H2O==SO42-+4H+HSO3--2e-+H2O=SO42-+3H+c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)
【解析】
(1) ①CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1,②H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1,③CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1,由盖斯定律分析,①+②×2-③得
CO(g)+2H2(g)===CH3OH(g)△H=(-283.0-285.8×2+764.5)=-90.1 kJ/mol .
(2) CO(g)+2H2(g)===CH3OH
起始a 2a 0
改变0.75a 1.5a 0.75a
平衡 0.25a 0.5a 0.75a
平衡常数K= ![]() =
=  =
= ![]() 。 (3) A.v(CO)=v(H2) 中不能反映正逆反应速率的关系,不能确定平衡状态,故错误;B.反应体系都为气体,在体积不变的情况下,混合气体的密度始终不变,故不能说明反应到平衡,故错误;C.混合气体的平均相对分子质量=混合气体的总质量/混合气体的总物质的量,因为混合气体的总质量不变,但是混合气体的物质的量随着时间改变而改变,所以当混合气体的平均相对分子质量不变,可以说明反应到平衡,故正确; D. c(CO)=c(H2)不能说明反应到平衡,故错误。故选C。 (4) 压缩容器体积或增大体系压强能增大v(CO)又能提高CO转化率。 (5)该原电池中,负极上失去电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失去电子和水反应生成硫酸,电极反应为 SO2-2e-+2H2O==SO42-+4H+。 (6)电解池中阳极和电源的正极相连,失去电子发生氧化反应,电解亚硫酸氢钠溶液可制得硫酸,硫的化合价升高,所以阳极室亚硫酸氢根离子溶液失去电子被氧化生成硫酸根离子,电极反应为:HSO3--2e-+H2O=SO42-+3H+ 。 (7) 已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知亚硫酸根离子的水解常数为
。 (3) A.v(CO)=v(H2) 中不能反映正逆反应速率的关系,不能确定平衡状态,故错误;B.反应体系都为气体,在体积不变的情况下,混合气体的密度始终不变,故不能说明反应到平衡,故错误;C.混合气体的平均相对分子质量=混合气体的总质量/混合气体的总物质的量,因为混合气体的总质量不变,但是混合气体的物质的量随着时间改变而改变,所以当混合气体的平均相对分子质量不变,可以说明反应到平衡,故正确; D. c(CO)=c(H2)不能说明反应到平衡,故错误。故选C。 (4) 压缩容器体积或增大体系压强能增大v(CO)又能提高CO转化率。 (5)该原电池中,负极上失去电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失去电子和水反应生成硫酸,电极反应为 SO2-2e-+2H2O==SO42-+4H+。 (6)电解池中阳极和电源的正极相连,失去电子发生氧化反应,电解亚硫酸氢钠溶液可制得硫酸,硫的化合价升高,所以阳极室亚硫酸氢根离子溶液失去电子被氧化生成硫酸根离子,电极反应为:HSO3--2e-+H2O=SO42-+3H+ 。 (7) 已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7,可知亚硫酸根离子的水解常数为![]() ,可知亚硫酸钠的水解和亚硫酸氢钠的电离程度相等,则知道由亚硫酸钠和亚硫酸氢钠形成的混合溶液恰好呈中性,可知亚硫酸根离子和亚硫酸氢根离子浓度相等,则溶液中的离子浓度关系为: c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)。
,可知亚硫酸钠的水解和亚硫酸氢钠的电离程度相等,则知道由亚硫酸钠和亚硫酸氢钠形成的混合溶液恰好呈中性,可知亚硫酸根离子和亚硫酸氢根离子浓度相等,则溶液中的离子浓度关系为: c(Na+)> c(HSO3-)= c(SO32-)> c(OH-)= c(H+)。


科目:高中化学 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
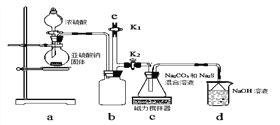
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
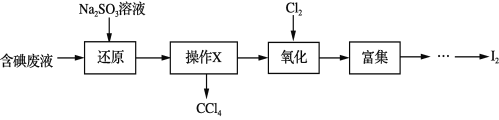
下列叙述不正确的是
A. “还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
B. “操作X”的名称为萃取,可在分液漏斗中进行
C. “氧化”过程中,可用双氧水替代氯气
D. “富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量报告中涉及的污染物主要是( )
A.Cl2、HCl 、酸雨B.SO2、NO2、可吸入颗粒物
C.NH3、CO、CO2D.SO2、N2、可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(2)CaC2中C22﹣与O22+互为等电子体,O22+的电子式可表示为________。
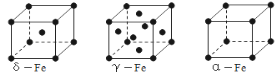
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为______(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学选修3:物质结构与性质】
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(l)基态Cr原子的电子排布式为____;Fe位于元素周期表的___ 区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为____,其中四种元素第一电离能由小到大的顺序是____。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?____。
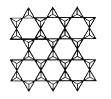
(4)在硅酸盐中存在![]() 结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)
结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)![]() 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个![]() 形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
若其中有一半的Si被Al替换,其化学式为____。
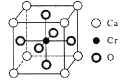
(5) Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为____,若Ca与O的核间距离为x nm,则该晶体的密度为___ g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于平衡膳食宝塔的认识中,正确的是
A.塔底的食物最重要
B.塔顶的食物最重要
C.膳食宝塔所列食物摄入量对任何人都是最佳摄入量
D.膳食宝塔所列食物摄入量是每人每日的建议摄入量,具体到不同的个体要根据自身的情况而调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某年世界无烟日的主题是“清洁空气,拒吸二手烟”。“二手”烟燃烧产生的烟气中含有三种主要毒素,除烟碱和致癌物焦油外,还有一种不易注意的有毒物质是( )
A.一氧化氮B.二氧化硫C.一氧化碳D.二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com