
(1)若要配制100mL的1.0mol/LNa2SO4溶液,需称量Na2SO4的质量为多少克?
(2)实验室里常用固体氯化铵与足量熟石灰加热制取氨。若需要2240mL(标准状况)氨,求至少需要氯化铵的质量。
(1)14.2g (2)5.35g
解析试题分析:(1)要配制100mL的0.1mol/LNa2SO4溶液,需称量Na2SO4的质量为
0.1L×1.0mol/L×142g/mol=14.2g
(2)氨气的物质的量是2.24L÷22.4L/mol=0.1mol
则根据氮原子守恒可知,需要氯化铵的物质的量也是0.1mol
质量是0.1mol×53.5g/mol=5.35g
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式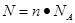 、n=m/M、
、n=m/M、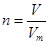 、
、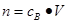 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:云南省建水一中2011-2012学年高二上学期期中考试试化学文科试题 题型:038
(1)若要配制100 mL 0.1 mol·L的Na2SO4溶液,需称量Na2SO4的质量为多少?
(2)将2240 mL(标准状况)氨完全溶于水配成100 mL溶液,求氨水中NH3的物质的量浓度(不考虑NH3与H2O的反应).
(3)在上一题的研究性学习中,若需要制取2240 mL(标准状况)氨,求至少需要氯化铵的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol的镁、铝混合物溶于100mL 2mol·L![]() 的H2SO4溶液中,然后再滴加1mol·L
的H2SO4溶液中,然后再滴加1mol·L![]() 的NaOH溶液。请回答:(不需要写出计算过程)
的NaOH溶液。请回答:(不需要写出计算过程)
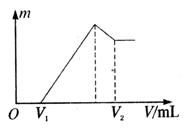
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中
mL时,则金属粉末中![]() (Mg)= mol,
(Mg)= mol,![]() mL。
mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有 。
②下列操作会使所配的溶液浓度偏小的是( )(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
查看答案和解析>>
科目:高中化学 来源:2010年河北省唐山一中高一上学期期中考试化学卷 题型:填空题
(10分)实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ( )
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是__________________________。
(3)容量瓶上除有刻度线外还应标有__________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
查看答案和解析>>
科目:高中化学 来源:2011-2012常年山东省恒台第二中学高一学分认定考试化学试卷 题型:实验题
(5分)实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
⑴.配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
⑵.用托盘天平称取氯化钠固体,其质量为__________ g。
⑶.下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
⑷.如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
查看答案和解析>>
科目:高中化学 来源:2011-2012常年山东省高一学分认定考试化学试卷 题型:实验题
(5分)实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
⑴.配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
⑵.用托盘天平称取氯化钠固体,其质量为__________ g。
⑶.下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
⑷.如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com