
【题目】通过海水晾晒可得粗盐,粗盐除NaCl 外,还含有 MgCl2、CaCl2、Na2SO4 以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确的是
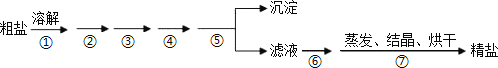
A.在第①、⑦步中都运用了玻璃棒的搅拌作用
B.第⑤步操作是过滤
C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH 溶液→Na2CO3 溶液→BaCl2 溶液→稀盐酸
D.除去MgCl2 的离子方程式为:Mg2++2OH=Mg(OH)2↓
【答案】C
【解析】
粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,除MgCl2用NaOH溶液,除CaCl2用Na2CO3,除Na2SO4用BaCl2溶液,但BaCl2的加入一定要在Na2CO3之前,加完三种试剂后,过滤,向滤液中加HCl溶液除去过量的Na2CO3,然后对所得溶液蒸发结晶即得精盐。
A.在第①步溶解时用玻璃棒搅拌,可以加速粗盐溶解,在第⑦步蒸发、结晶、烘干时用玻璃棒搅拌,使之受热均匀,避免产生飞溅,故A正确;
B.固液分离的操作是过滤,故B正确;
C.BaCl2溶液的加入一定要在Na2CO3溶液之前,否则过量的Ba2+无法除去,且一定要先过滤,再向滤液中加HCl,加入试剂正确顺序为NaOH 溶液→BaCl2 溶液→Na2CO3 溶液→过滤后在滤液中加稀盐酸,故C错误;
D.向粗盐中加NaOH除去MgCl2,其离子方程式为:Mg2++2OH-=Mg(OH)2↓,故D正确;
答案为C。


科目:高中化学 来源: 题型:
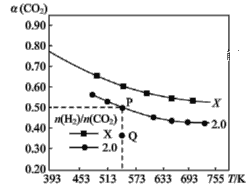
【题目】在两个固定体积均为1 L密闭容器中以不同的氢碳比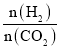 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如图所示。下列说法正确的是 ( )
A.该反应在常温下不可能自发进行
B.氢碳比,X<2.0
C.若起始时CO2、H2浓度分别为0.5 mol·L-1、1.0 mol·L-1,则可得P点对应温度的平衡常数的值为512
D.向P点状态的容器中,按2∶4∶1∶4的比例再充入CO2、H2、C2H4、H2O,再次平衡后α(CO2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3,[Fe(H2NCONH2)6](NO3)3等。
(1)Fe2+基态核外电子排布式为___。
(2)与CN-互为等电子体的一种分子是:___,CN-可在TiO2作光催化剂下转化为OCN-,OCN-中三种元素的电负性由大到小的顺序为___,尿素(H2NCONH2)分子中C、N原子的杂化方式分别为___和___。
(3)NO3-的空间构型为___,1molFe(CN)63-中含有σ键的数目为___。
(4)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则X=___,已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)X晶体属于___(填晶体类型)。
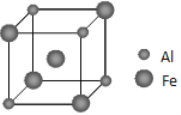
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。则这种晶胞中,离Al原子最近且距离相等的Fe原子有___个,该晶体的密度的计算式为:___(不用化简,已知小立方体的边长为acm,阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.2 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 1.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙醇、乙醛的沸点分别为78℃、20.8℃。某同学试图利用下列实验装置来完成“乙醛的制备、收集和检验”一系列实验,其中设计不合理的是( )
A.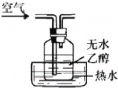 提供乙醇蒸气和氧气
提供乙醇蒸气和氧气
B.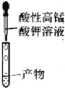 检验乙醛
检验乙醛
C.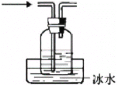 收集产物
收集产物
D.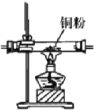 乙醇的催化氧化
乙醇的催化氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用 30%的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)在加入①物质的过程中通常不断搅拌,搅拌的目的是_____。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 FeCl3 溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式:①________,④____。
(3)要证明某溶液中不含 Fe3+而可能含有 Fe2+,进行如下实验操作时的最佳顺序为__________。
①加入足量氯水 ②加入足量KMnO4 溶液 ③加入少量KSCN 溶液
A.①③ B.③② C.③① D.①②③
(4)写出向②⑤的混合液中通入⑥的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学根据下列仪器设计实验装置证明上述结论。请按要求回答问题。

(1)U形接管中所盛试剂的化学式为_______________。
(2)检验产物中HCl 的离子方程式:____________________。
(3)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在________________之间(填装置序号)瓶中可以放入_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com