
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдкШ§ИіЬхЛ§ОљЮЊ2.0LЕФКуШнУмБеШнЦїжаЗжБ№МгШывЛЖЈСПЕФXЃЌЗЂЩњЗДгІЃКpX(g) ![]() Y(g)+Z(g)ЃЌЯрЙиЪ§ОнШчЯТБэЫљЪОЃК
Y(g)+Z(g)ЃЌЯрЙиЪ§ОнШчЯТБэЫљЪОЃК
ШнЦїБрКХ | ЮТЖШ(Ёц) | Ц№ЪМЮяжЪЕФСП(mol) | ЦНКтЮяжЪЕФСП(mol) | |
X(g) | Y(g) | Z(g) | ||
Ђё | 387 | 0.20 | 0.080 | 0.080 |
Ђђ | 387 | 0.40 | 0.160 | 0.160 |
Ђѓ | T | 0.20 | 0.090 | 0.090 |
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШєШнЦїЂёжаЗДгІО10minДяЕНЦНКтЃЌдђЧА10minФкYЕФЦНОљЗДгІЫйТЪv(Y)=___________ЁЃШнЦїЂёКЭШнЦїЂђжаЦ№ЪМЪБXЕФЗДгІЫйТЪv(X)Ђё___________v(X)Ђђ(ЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)ЁЃ
ЃЈ2ЃЉвбжЊИУе§ЗДгІЮЊЗХШШЗДгІЃЌдђT___________387(ЬюЁАДѓгкЁБЛђЁАаЁгкЁБ)ЃЌХаЖЯРэгЩЪЧ___________ЁЃ
ЃЈ3ЃЉЗДгІЗНГЬЪНжаXЕФЛЏбЇМЦСПЪ§pЕФШЁжЕЮЊ___________ЃЌШнЦїЂђжаXЕФЦНКтзЊЛЏТЪЮЊ___________ЁЃШєЦ№ЪМЪБЯђШнЦїЂёжаГфШы0.1molXЁЂ0.15molYКЭ0.10molZЃЌдђЗДгІНЋЯђ___________ (ЬюЁАе§ЁБЛђЁАФцЁБ)ЗДгІЗНЯђНјааЃЌХаЖЯРэгЩЪЧ_____________________________________________________ЁЃ
ЁОД№АИЁП 0.0040mol/(LЁЄmin) аЁгк аЁгк ЯрЖдгкШнЦїЂёЃЌШнЦїЂѓЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌМДНЕЕЭЮТЖШ(Лђе§ЗДгІЮЊЗХШШЗДгІЃЌЦНКтЯђЗХШШЗДгІЗНЯђвЦЖЏЃЌЙЪЮТЖШНЕЕЭ) 2 80% е§ ИљОнШнЦїЂёжаЪ§ОнПЩМЦЫуЕУЕН387ЁцИУЗДгІЕФЦНКтГЃЪ§ЮЊ4ЃЌ 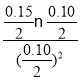 =1.5<4ЃЌЫљвдЗДгІЯђе§ЗДгІЗНЯђНјаа
=1.5<4ЃЌЫљвдЗДгІЯђе§ЗДгІЗНЯђНјаа
ЁОНтЮіЁПЪдЬтЗжЮіЃКБОЬтПМВщЛЏбЇЗДгІЫйТЪКЭЛЏбЇЦНКтЕФМЦЫуЃЌЮТЖШЁЂбЙЧПЖдЛЏбЇЦНКтЕФгАЯьЃЌЛЏбЇЦНКтГЃЪ§ЕФгІгУЁЃ
ЃЈ1ЃЉШнЦїIжаІдЃЈYЃЉ=![]() =0.0040mol/ЃЈLЁЄminЃЉЁЃШнЦїIКЭШнЦїIIЮТЖШЯрЭЌЃЌШнЦїIIжаXЕФЦ№ЪМХЈЖШЮЊШнЦїIжаЕФСНБЖЃЌдђЦ№ЪМЗДгІЫйТЪІдЃЈXЃЉIаЁгкІдЃЈXЃЉIIЁЃ
=0.0040mol/ЃЈLЁЄminЃЉЁЃШнЦїIКЭШнЦїIIЮТЖШЯрЭЌЃЌШнЦїIIжаXЕФЦ№ЪМХЈЖШЮЊШнЦїIжаЕФСНБЖЃЌдђЦ№ЪМЗДгІЫйТЪІдЃЈXЃЉIаЁгкІдЃЈXЃЉIIЁЃ
ЃЈ2ЃЉИУЗДгІЕФе§ЗДгІЮЊЗХШШЗДгІЃЌЩ§ИпЮТЖШЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЛШнЦїIКЭШнЦїIIIЮТЖШВЛЭЌЃЌXЦ№ЪМЮяжЪЕФСПЯрЭЌЃЌЦНКтЪБШнЦїIIIжаYЁЂZЮяжЪЕФСПДѓгкШнЦїIжаЃЌШнЦїIIIЯрЖдгкШнЦїIЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌдђTаЁгк387ЁЃ
ЃЈ3ЃЉШнЦїIIКЭШнЦїIЮТЖШЯрЭЌЃЌШнЦїIIжаXЦ№ЪМЮяжЪЕФСПЮЊШнЦїIжаЕФСНБЖЃЌШнЦїIIЯрЕБгкдкШнЦїIЛљДЁЩЯНЋЬхЛ§ЫѕаЁЮЊдРДЕФвЛАыЃЌЦНКтЪБШнЦїIIжаYЁЂZЮяжЪЕФСПЮЊШнЦїIжаЕФСНБЖЃЌМДдіДѓбЙЧПЃЌЦНКтВЛвЦЖЏЃЌдђp=1+1=2ЁЃЗДгІЕФЗНГЬЪНЮЊ2XЃЈgЃЉ![]() YЃЈgЃЉ+ZЃЈgЃЉЃЌдђШнЦїIIЩњГЩ0.160molYЯћКФ0.320molXЃЌШнЦїIIжаXЕФЦНКтзЊЛЏТЪЮЊ
YЃЈgЃЉ+ZЃЈgЃЉЃЌдђШнЦїIIЩњГЩ0.160molYЯћКФ0.320molXЃЌШнЦїIIжаXЕФЦНКтзЊЛЏТЪЮЊ![]() 100%=80%ЁЃШнЦїIжаЩњГЩ0.080molYЯћКФ0.160molXЃЌШнЦїIЦНКтЪБXЁЂYЁЂZЮяжЪЕФСПвРДЮЮЊ0.04molЁЂ0.08molЁЂ0.08molЃЌЦНКтЪБXЁЂYЁЂZЮяжЪЕФСПХЈЖШвРДЮЮЊ0.02mol/LЁЂ0.04mol/LЁЂ0.04mol/LЃЌ387ЁцЪБЗДгІЕФЛЏбЇЦНКтГЃЪ§K=
100%=80%ЁЃШнЦїIжаЩњГЩ0.080molYЯћКФ0.160molXЃЌШнЦїIЦНКтЪБXЁЂYЁЂZЮяжЪЕФСПвРДЮЮЊ0.04molЁЂ0.08molЁЂ0.08molЃЌЦНКтЪБXЁЂYЁЂZЮяжЪЕФСПХЈЖШвРДЮЮЊ0.02mol/LЁЂ0.04mol/LЁЂ0.04mol/LЃЌ387ЁцЪБЗДгІЕФЛЏбЇЦНКтГЃЪ§K=![]() =4ЃЌДЫЪБЕФХЈЖШЩЬЮЊ
=4ЃЌДЫЪБЕФХЈЖШЩЬЮЊ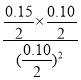 =1.5<4ЃЌЫљвдЗДгІЯђе§ЗДгІЗНЯђНјааЁЃ
=1.5<4ЃЌЫљвдЗДгІЯђе§ЗДгІЗНЯђНјааЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКHCN(aq)гыNaOH(aq)ЗДгІЕФЁїH=Ѓ12.1kJ /molЃЛHCl(aq)гыNaOH(aq)ЗДгІЕФЁїH =Ѓ55.6kJ/ molЁЃдђHCNдкЫЎШмвКжаЕчРыЕФІЄHЕШгк
A. Ѓ67.7 kJ /mol B. Ѓ43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЬхЛ§ЙЬЖЈЕФУмБеШнЦїжаНјааПЩФцЗДгІ2NO2![]() 2NO+O2ЃЌЯТСаФмзїЮЊЗДгІДяЕНЦНКтзДЬЌБъжОЕФЪЧ( )
2NO+O2ЃЌЯТСаФмзїЮЊЗДгІДяЕНЦНКтзДЬЌБъжОЕФЪЧ( )
ЂйЕЅЮЛЪБМфФкЩњГЩnmol O2ЕФЭЌЪБЩњГЩ2n mol NO2
ЂкЕЅЮЛЪБМфФкЩњГЩn mol O2 ЕФЭЌЪБЩњГЩ2n mol NO
ЂлгУNO2 ЁЂNOЁЂO2БэЪОЕФЗДгІЫйТЪжЎБШЮЊ2ЁУ2ЁУ1
ЂмЛьКЯЦјЬхЕФбеЩЋВЛдйИФБф ЂнЛьКЯЦјЬхЕФУмЖШВЛдйИФБф
ЂоЛьКЯЦјЬхЕФбЙЧПВЛдйИФБф ЂпЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
AЃЎЂйЂмЂоЂп BЃЎЂкЂлЂнЂп CЃЎЂйЂлЂмЂн DЃЎШЋВП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌH3AsO4ШмвКжаИїКЌЩщСЃзгЗжВМЗжЪ§(ЦНКтЪБИУСЃзгЕФХЈЖШгыИїКЌЩщСЃзгХЈЖШжЎКЭЕФБШ)гыpHЕФЙиЯЕШчгвЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
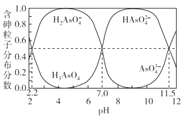
A. H3AsO4ЕФЕквЛВНЕчРыГЃЪ§Ka1>0.01
B. pH=7.0ЪБЃЎШмвКжаc(AsO43-)=c(H3AsO4)=0
C. 0.1molЁЄL-1H3AsO4ШмвКЕФpH<2
D. pH=12ЪБЃЌc(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГШЛЈДМОпгаУЕЙхМАЦЛЙћЯуЦјЃЌПЩзїЮЊЯуСЯЃЌЦфНсЙЙМђЪНШчЯТЃК
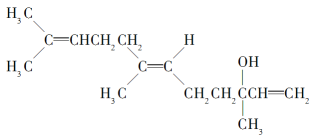
ЯТСаЙигкГШЛЈДМЕФа№ЪіЃЌДэЮѓЕФЪЧ(ЁЁЁЁ)
A. МШФмЗЂЩњШЁДњЗДгІЃЌвВФмЗЂЩњМгГЩЗДгІ
B. дкХЈСђЫсДпЛЏЯТМгШШЭбЫЎЃЌПЩЩњГЩВЛжЙвЛжжЫФЯЉЬў(ЗжзгжаКЌгаЫФИіЬМЬМЫЋМќЕФЯЉЬў)
C. 1 molГШЛЈДМдкбѕЦјжаГфЗжШМЩеЃЌашЯћКФ470.4 LбѕЦј(БъзМзДПі)
D. 1 molГШЛЈДМдкЪвЮТЯТгыфхЕФЫФТШЛЏЬМШмвКЗДгІЃЌзюЖрЯћКФ240 g Br2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщЖдвЛжжЗЯОЩКЯН№(КЌгаCuЁЂFeЁЂSiЕШдЊЫи)НјааЗжРыЁЂЛиЪедйРћгУЃЌЫљЩшМЦЙЄвеСїГЬШчЯТЁЃ
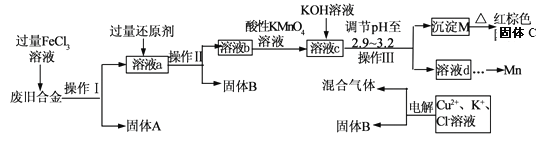
вбжЊ:298KЪБЃЌKsp[Fe(OH)3]=4.0ЁС10ЁЊ38ЃЌKsp[Cu(OH)2]=2.2ЁС10вЛ20ЃЌ
Ksp[Mn(OH)2]=1.9ЁС10ЁЊ13
ЛиД№ЯТСаЮЪЬт:
(1)ВйзїIЁЂЂђЁЂЂѓЮЊ________ЃЌЙЬЬхBЮЊ_________ (ЬюЛЏбЇЪН)ЁЃ
(2)МгШЫЙ§СПFeCl3ШмвКЙ§ГЬжагыНЯВЛЛюЦУЕФН№ЪєЗДгІЕФРызгЗНГЬЪН__________________ЁЃ
(3)ЕїНкpHжС2.9ЁЋ3.2ЕФФПЕФЪЧЗжРы_________ (ЬюРызгЗћКХ)
(4)ЂйЯђШмвКbжаМгШыЫсадKMnO4ШмвКЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_________________ЁЃ
ЂкШєгУ a mol/LKMnO4ШмвКДІРэШмвКbЃЌЕБЧЁКУЗДгІЪБЯћКФKMnO4ШмвКV mLЃЌЫљЕУКьзиЩЋЙЬЬхCЕФЮяжЪЕФСПЮЊ_________(гУКЌaЁЂvЕФДњЪ§ЪНБэЪО)
(5)ГЃЮТЯТЃЌШєШмвКcжаЫљКЌЕФН№ЪєбєРызгХЈЖШЯрЕШЃЌЯђШмвКcжаж№ЕЮМгШыKOHШмвКЃЌзюКѓЩњГЩЕФГСЕэЮЊ_________ (ЬюЛЏбЇЪН)ЁЃ
(6)гУЖшадЕчМЋЕчНтЪБбєМЋВњЩњБъзМзДПіЯТЕФЦјЬх6.72LЃЌвѕМЋЕУЕНЕФЕчзгЪ§ЮЊ0.8NAЃЌдђЩњГЩбѕЦјЕФЮяжЪЕФСПЮЊ________ mol.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГ§ШЅУОЗлжаЛьгаЕФЩйСПТСЗлЃЌПЩбЁгУЕФЪдМСЪЧЃЈ ЃЉ
A.бЮЫс
B.NaOHШмвК
C.ЯѕЫс
D.ЪГбЮЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЪ§ОнжаЃЌЧАепИеКУЪЧКѓепСНБЖЕФЪЧ
A. 2 molЫЎЕФФІЖћжЪСПКЭ1 molЫЎЕФФІЖћжЪСП
B. 200 mL 1 molЁЄLЃ1ТШЛЏИЦШмвКжаc(ClЃ)КЭ100 mL 2 molЁЄLЃ1ТШЛЏМиШмвКжаc(ClЃ)
C. БъзМзДПіЯТЃЌ22.4 LвЛбѕЛЏЬМжабѕдзгЪ§КЭ16 gЖўбѕЛЏСђжабѕдзгЪ§
D. 2 molЁЄLЃ1H2SO4ШмвКжаЕФHЃЋИіЪ§гы1 molЁЄLЃ1HClШмвКжаЕФHЃЋИіЪ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБЦјгаЙуЗКгУЭОЃЌЙЄвЕЩЯРћгУЗДгІN2(g)+3H2(g)![]() 2NH3(g) H<0КЯГЩАБЃЌЛиД№вдЯТЮЪЬтЃК
2NH3(g) H<0КЯГЩАБЃЌЛиД№вдЯТЮЪЬтЃК
ЃЈ1ЃЉФГаЁзщЮЊСЫЬНОПЭтНчЬѕМўЖдЗДгІЕФгАЯьЃЌвдc0 mol/L H2ВЮМгКЯГЩАБЗДгІЃЌдкaЁЂbСНжжЬѕМўЯТЗжБ№ДяЕНЦНКтЃЌШчЭМAЁЃ
ЂйaЬѕМўЯТЃЌ0ЁЋt0ЕФЦНОљЗДгІЫйТЪv(H2)=_____________molЁЄL-1ЁЄmin-1ЁЃ
ЂкЯрЖдaЖјбдЃЌbПЩФмИФБфЕФЬѕМўЪЧ________________ЁЃ
ЂлдкaЬѕМўЯТt1ЪБПЬНЋШнЦїЬхЛ§бЙЫѕжСдРДЕФ1/2ЃЌt2ЪБПЬжиаТНЈСЂЦНКтзДЬЌЁЃЧыдкД№ЬтПЈЯргІЮЛжУЛГіt1ЪБПЬКѓc(H2)ЕФБфЛЏЧњЯпВЂзїЯргІЕФБъзЂЁЃ_____________
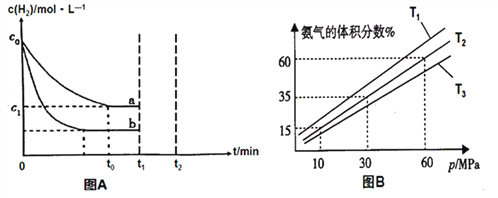
ЃЈ2ЃЉФГаЁзщЭљвЛКуЮТКубЙШнЦїГфШы9mol N2КЭ23mol H2ФЃФтКЯГЩАБЗДгІЃЌЭМBЮЊВЛЭЌЮТЖШЯТЦНКтЛьКЯЮяжаАБЦјЕФЬхЛ§ЗжЪ§гызмбЙЧПЃЈpЃЉЕФЙиЯЕЭМЁЃ
Ђй БШНЯT1ЁЂT3ЕФДѓаЁT1__________T3ЃЈЬюЁА<ЁБЛђЁА>ЁБЃЉЁЃ
ЂкЗжЮіЬхЯЕдкT2ЁЂ60MPaЯТДяЕНЕФЦНКтЃЌДЫЪБN2ЕФЦНКтЗжбЙЮЊ_______MPaЃЈЗжбЙЃНзмбЙЁСЮяжЪЕФСПЗжЪ§ЃЉЃЛСаЪНБэЪОДЫЪБЕФЦНКтГЃЪ§Kp=______________ЁЃЃЈгУЦНКтЗжбЙДњЬцЦНКтХЈЖШЃЌВЛвЊЧѓМЦЫуНсЙћЃЉ
ЃЈ3ЃЉгаШЫРћгУNO2КЭNH3ЙЙГЩЕчГиЕФЗНЗЈЃЌМШФмЪЕЯжгааЇЯћГ§ЕЊбѕЛЏЮяЕФХХЗХМѕЩйЛЗОГЮлШОЃЌгжФмГфЗжРћгУЛЏбЇФмНјааДжЭОЋСЖЃЌШчЭМCЫљЪОЃЌdМЋЮЊДжЭЁЃ
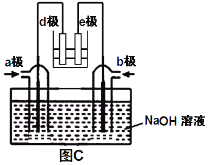
Ђй aМЋЭЈШы________(ЬюЛЏбЇЪН)ЃЛ
Ђк bМЋЕчМЋЗДгІЮЊ_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com