
氢是宇宙中最丰富的元素,为一切元素之源。
23.1.H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号)。
a.电子层 b.电子亚层
c.电子云的伸展方向 d.电子的自旋
24.2.金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号)。
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 。
核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 。
25.3.非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 。
26.4.根据下表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 。
在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 。
共价键 | 键能(KJ/ mol) |
N≡N | 946 |
H-H | 436 |
H-N | 391 |
27.5.钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g) 2PdHx (s) +Q(Q>0)
2PdHx (s) +Q(Q>0)
通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx 产生H原子并在固体中快速流动,可采取的措施是 (选填编号)。
a.升温 b.减压 c.及时移走金属钯
23.1.d
24.2.b;Li+[:H]-;H->Li+>Be2+(漏写、多写不给分)
25.3.R2On 或ROn/2(1分,写对1个即可)
26.4. N2(g)+3H2(g)  2 NH3(g) ΔH=-92 kJ/mol;
2 NH3(g) ΔH=-92 kJ/mol;
降低能耗、提高反应物的转化率(不答提高反应物的转化率不扣分)
27.5.降温、增压;a。
【解析】
试题分析:
23.1.描述电子运动状态的四个方面 :电子层、电子亚层、电子云的伸展方向、电子的自旋;1s1中系数1表示电子层,s表示电子亚层及伸展方向(s为球形)。故只有电子自旋方向没有表示出来。
24.2.b正确。因LiH是离子化合物,所以其电子式为Li+[:H]-,核外有2个电子的简单阴、阳离子有H-、Li+、Be2+,三者核外电子排布相同,则质子数越大半径越小,所以H->Li+>Be2+
25.3.非金属元素R的气态氢化物的化学式为H8-nR则,R的最低负价为-(8-n)价,则其最高正价为8-(8-n)=n。则其最高价氧化物的化学式为:当n为偶数时ROn/2,当n为奇数时R2On
考点:理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。会写简单物质的电子式。
26.4.H2(g)+N2(g) 2NH3(g)的焓变:
2NH3(g)的焓变:
ΔH=3×436 kJ·mol-1+946kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,
合成氨反应为放热反应,温度降低有利于反应的正向进行提高转化率,但温度降低反应速率反减慢,而催化剂可大幅度提高化学反应速率故活性温度更低的新催化剂可以降低能耗、提高反应物的转化率。
27.5.x的值增大。为使PdHx 产生H原子并在固体中快速流动加快反应速率可采取升温的方法。
考点:原子核外电子排布规律,了解化学反应热或焓变的含义,能应用键焓计算焓变。了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。


科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:实验题
电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
(2)I中加入过量Fe粉 ,然后过滤,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是HCl。.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 。
(2)试剂A是 。
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是 。
a.检验Cl2的存在 b检验Fe3+的存在 c.检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是 (填字母)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
已知短周期元素A、B、C、D最高价氧化物对应的水化物分别为X、Y、Z、W。A是短周期中原子半径最大的元素。常温下X、Z、W均可与Y反应,0.1 mol/L X、Z、W溶液的pH如图所示。(横坐标表示X,Z,W对应的A,C,D的原子序数)

下列说法正确的是
A.B的离子半径大于A的离子半径
B.C的氢化物的稳定性大于D的氢化物的稳定性
C.X、W两物质含有的化学键类型相同
D.B原子的电子层数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列描述中正确的是
A.CS2为直线形的极性分子
B.NH4+中N-H键能、键长和键角均相同
C.AB2为V形,则A一定为sp2杂化
D.SiF4和SO的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
醛类是重要的有机物。
47.1.松柏醇臭氧化反应生成的B含有醛基。

写出结构简式:B ;A 。
48.2.已知:
②醛甲+醛乙 醇+羧酸(歧化反应,简单的醛被氧化)
醇+羧酸(歧化反应,简单的醛被氧化)
醛基旁边的碳原子上的H原子叫α-H原子,比较活泼。制备季戊四醇的反应“流程”如下:

(1)写结构简式:D ;季戊四醇 。
(2)月桂酸季戊四醇酯[C12H25COOCH2C(CH2OH)3]是一种优良的中性洗涤剂, 试简述其可做洗涤剂的结构原因 。
(3)实际生产中甲醛过量,原因是 。
49.3.酯交换反应是指:酯+醇(酚)→新酯+新醇(酚)。松柏醇的一种芳香族同分异构体有以下特点:
①有邻位的2个取代基;②遇氯化铁溶液呈紫色;③发生分子内的酯交换反应,生成有六元环的内酯和甲醇,则该内酯的结构简式为 。
50.4.环己酮中α-H也比较活泼,能发生反应: ,则E的结构简式为 。
,则E的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
一定条件下,卤代烃和金属钠能发生伍兹反应:RX +2Na+ R,X→R-R,+2NaX,反应中有C-X键
的断裂和C-C键的形成。据此,以下卤代烃伍兹反应的可能产物(不考虑NaX)及命名合理的是
A.一氯甲烷和2-氯丙烷:正丁烷
B.2,2-二甲基-1-氯丙烷与一氯甲烷:3,3-二甲基丁烷
C.1,5-二氯戊烷:环戊烷
D.四氯化碳:金刚石
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
分子式为C5H12O的有机物共有8种属于醇类的同分异构体,其中含有-CH2OH基团的有
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
A.0.2mol B.0.6mol
C.0.8mol D.1.0mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三1月练习理综化学试卷(解析版) 题型:填空题
(16分)
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
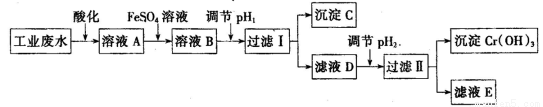
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O;
Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5 mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为 (填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为 ,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
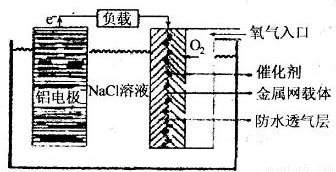
(6)该电池的总反应化学方程式为 ;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com