
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是
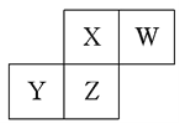
A. 元索Ⅹ和元Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(X)
C. 气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D. 元素Z的氧化物对应水化物都是强酸
【答案】C
【解析】
通过图中信息及四种元素为短周期,可确定,X、W为第二周期相邻元素,Y、Z为第三周期相邻元素,且X、Z同主族,四种原了最外层电子数之和为24,设X最外层电子数为x,则x+x+1+x+x-1=24,x=6,X为O,W为F,Y为P,Z为S。
A.O和S为同主族,但由于O的氧化性较强,无正价,A错误;
B.O2-、F-具有相同的核外电子排布,原子序数越大半径越小,r(X) >r(W),B错误;
C.根据元素周期律,非金属元素的非金属性越强,其气态氢化物的稳定性越强,非金属性:F>O>S>P,气态氢化物的稳定性:W>X>Z>Y,C正确;
D.S元素+4价的氧化物对应水化物为亚硫酸,为弱酸,D错误;
答案为C


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) △H=-1256kJ/mol,下列说法正确的是( )
O2(g)=2CO2(g)+H2O(g) △H=-1256kJ/mol,下列说法正确的是( )
A.乙炔的燃烧热为1256kJ·mol-1
B.若生成2mol液态水,则放出的热量为2512 kJ·mol-1
C.若转移10mol电子,则消耗2.5mo1 O2
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素化合价与原子序数的关系如图,下列说法正确的是( )
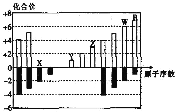
A.原子半径:Z > Y > X
B.气态氢化物的稳定性 R < W
C.Y 和 Z 的最高价氧化物对应的水化物能相互反应
D.W 与 X 形成的化合物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知H2O2足量,下列说法正确的是( )
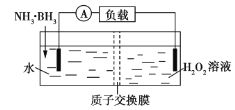
A.正极的电极反应式为2H++2e-=H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作足够长时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,A、B、D都为气体,且B、D起始浓度为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:

根据上述数据,回答以下问题:
(1)实验1中,10至30分钟时间内A的平均反应速率为________mol·L-1·min-1,达平衡时B物质的浓度为________,A的转化率为________。
(2)实验2中,隐含的反应条件可能是________。
(3)实验3中,A的起始的物质的量________(填“>”“<”或“=”)1.0 mol,实验3和实验1的起始速率v3________(填“>”“<”或“=”)v1,由实验1和实验5可确定上述反应为________(填“放热”或“吸热”) 反应,实验4中,该反应温度下其平衡常数为________。
(4)若开始时在实验2的密闭容器中充入1.0molB,1.0molD,达平衡时A物质的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成NH3的原理示意图如图所示。下列说法不正确的是( )
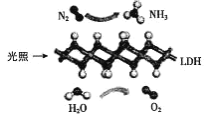
A.该反应属于置换反应
B.该过程中只涉及极性键的断裂与生成
C.基于 LDH 合成 NH3的过程属于氮的固定
D.该过程中每生成 2.24L(标准状况)O2则转移 0.4mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀):
![]()
![]()
![]() ,②
,②![]()
![]()
![]()
![]()
![]() →CuSO4·5H2O晶体
→CuSO4·5H2O晶体
下列分析中正确的是
A. 用98%的浓硫酸配制溶解所用的4.5 mol·L-1的稀硫酸,只需3种玻璃仪器
B. 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量氯气
C. 利用Cu(OH)2替代CuO也可调节溶液pH而不影响实验结果
D. 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、玻璃棒、酒精灯、泥三角、三脚架
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
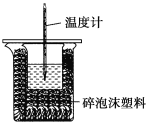
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为____。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~2s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com