
可以把6种无色溶液:乙醇、苯酚、NaHCO3溶液、AgNO3溶液、KOH溶液、氢硫酸一一区分的试剂是:
A.新制碱性 悬浊液 悬浊液 | B.FeCl3溶液 |
| C.BaCl2溶液 | D.酸性KMnO4溶液 |
B
解析试题分析:新制的氢氧化铜悬浊液只能和酸会含有醛基的有机物反应,因此不能鉴别这6种物质,所以A错误;苯酚和FeCl3溶液显紫色,乙醇和FeCl3溶液无明显现象,KOH溶液和FeCl3溶液有红褐色沉淀,AgNO3溶液和FeCl3溶液有白色沉淀,碳酸氢钠溶液和FeCl3溶液反应生成红褐色测定和CO2气体,和H2S反应生成单质S沉淀,现象各不相同,故B正确;氯化钡溶液只能和硝酸银溶液反应生成白色沉淀氯化银,因此不能鉴别这6种物质,所以C错误;乙醇、苯酚和H2S均能使酸性高锰酸钾溶液褪色。NaHCO3溶液、AgNO3溶液、KOH溶液与高锰酸钾不反应,不能鉴别这6这物质,所以D不正确,答案选B。
考点:考查物质的鉴别
点评:该题是高考中的常见题型,属于中等难度的试题,侧重对学生分析、归纳和总结问题的能力的培养。答题时需要学生掌握好物质的性质与反应现象,要注意知识的总结和积累。该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。


科目:高中化学 来源: 题型:单选题
实验是化学研究的基础,下列关于各实验装置的叙述正确的是
① ② ③ ④
| A.装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列提纯物质(括号中为杂质)的试剂和分离方法正确的是
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)有如图所示A~F六种仪器:
(1)写出仪器名称:D ,E ;
(2)请举例说出仪器A的用途(两种或两种以上) ;
(3)实验室配制一定物质的量浓度的盐酸,需用36.5%的浓盐酸4.5mL。取用4.5mL盐酸时,需要到上图仪器中的F和 (填编号);
(4)下列实验操作中用到仪器C的是 (选填下列选项的字母编号)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥砂的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下: 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):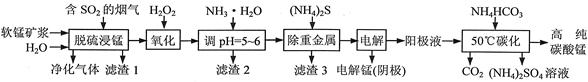
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com