
下列提纯物质(括号中为杂质)的试剂和分离方法正确的是
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
C
解析试题分析:乙烯含有碳碳双键,能被酸性高锰酸钾溶液氧化生成CO2,所以选项A不正确,应该用溴水;B中的氢氧化钠溶液也能和乙酸乙酯反应,不正确,应该用饱和碳酸钠溶液;C中的生石灰和乙酸反应,然后蒸馏即可得到无水乙醇,C正确;D中浓溴水和苯酚反应生成的三溴苯酚,能溶解在苯,不正确,应该用氢氧化钠溶液,然后分液,答案选C。
考点:考查物质的分离与提纯
点评:该题是高考中的常见题型,属于中等难度实验题的考查。明确有关物质的性质,是分离的关键。该类试题需要注意的是在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。


科目:高中化学 来源: 题型:单选题
下列实验,所选装置不合理的是
① ② ③ ④
| A.除去CO2中的HCl,选① |
| B.分离碘的CCl4溶液和水,选② |
| C.除去乙醇中的苯酚,选③ |
| D.分离CCl4(沸点76.8℃)和正丁醇(沸点117.2℃),选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.用盐析法分离NaCl溶液和淀粉胶体 |
| B.除去苯中少量苯酚,向混合物中加人足量的NaOH溶液后过滤 |
| C.加足量的稀盐酸可除去BaCO3固体中少量的BaSO4 |
| D.向硝酸银稀溶液中逐滴加人稀氨水至白色沉淀恰好溶解,即得银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述不正确的是( )
| A.可以用溴水来鉴别乙烯和苯 |
| B.可以用金属钠来鉴别乙醇和乙酸 |
| C.可以用新制的氢氧化铜来鉴别葡萄糖和淀粉 |
| D.可以用灼烧的方法来鉴别真丝布料和纯棉布料 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可以把6种无色溶液:乙醇、苯酚、NaHCO3溶液、AgNO3溶液、KOH溶液、氢硫酸一一区分的试剂是:
A.新制碱性 悬浊液 悬浊液 | B.FeCl3溶液 |
| C.BaCl2溶液 | D.酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:
实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后,在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。
(1)写出实验仪器名称:a ; b 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: 。
(3)步骤3趁热抽滤的目的是: ;如何证明步骤3滤渣已洗涤干净: 。
(4)步骤4用盐酸酸化的目的是: 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂。其化学名称为“乙酸三氯甲基苯甲酯”通常用三氯甲基苯基甲醇和醋酸酐为原料制备:
已知:
| 三氯甲基苯基甲醇 | 式量:224.5。无色液体。不溶于水,溶于乙醇。 |
| 醋酸酐 | 无色液体。溶于水形成乙酸,溶于乙醇。 |
| 结晶玫瑰 | 式量:267.5。白色至微黄色晶体。熔点:88℃。不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g。 |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇。 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在 中,按粗产品、溶剂的质量比为1: 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
| ② | 将步骤1所得溶液___________ | | |
| ③ | 干燥步骤2所得白色晶体, | __________________ | 白色晶体是结晶玫瑰 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: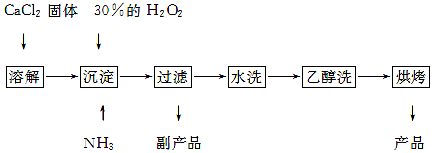
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ;
② 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com