
【题目】下列关于乙烯的叙述不正确的是( )
A.乙烯的化学性质比乙烷活泼
B.乙烯燃烧时火焰明亮,同时有少量黑烟
C.乙烯可作香蕉等水果的催熟剂
D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103 mol·L1 。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
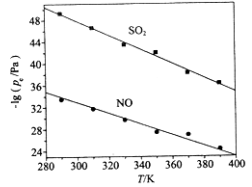
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是( )
A.制CuSO4:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2=2CuO;Cu+H2SO4(稀)=CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
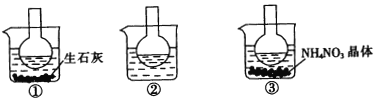
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是___________.
A.水解反应为放热 反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向三份0.01 mol L—1的CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体,则CH3COO-的水解平衡分别________、_________、_________。(填向“左移动”“向右移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】30mlCO2和NO混合气体通入足量的Na2O2固体并且充分反应后,气体体积变为20ml,则原混合气体中CO2体积为(同温同压下) ( )
A. 30mL B. 20mL C. 10mL D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凤凰石是一种用于建材装饰的硅酸盐矿物,已知某地出产的凤凰石可看作由主要成分硅酸铜盐X·3H2O(摩尔质量=334g/mol)与含氧酸盐杂质Y共同组成,X、Y均含三种元素,工业上利用下列流程制备铜盐,在溶液Ⅱ中滴入KSCN溶液显血红色。

请回答:
(1)杂质Y中除氧以外还含有的元素为_____(填元素符号),x的化学式为_______。
(2)如果王溶液Ⅱ中继续加入H2O2,发现有气泡产生,有观点认为是Y中的某元素离子将H2O2氧化所导致,写出反应的离子方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com