
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g) + 2B(g) ![]() 4C(?) + 2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度测量),则下列说法正确的是( )
4C(?) + 2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是![]()
B.增加C,B的平衡转化率不变
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是35%
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量变大
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增加反应物的浓度,反应速率加快,原因是单位体积内增加了活化分子的数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,
反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,
温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列
叙述正确的是
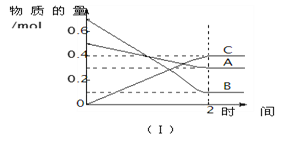
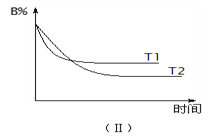
A. 2 min内A的化学反应速率为0.1 mol/(L·min)
B. 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C. 在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D. 在T℃时,若A的浓度减少了0.1 mol/L,则B的浓度会减少0.3 mol/L,C的浓度会增加0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a ___________0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的物质的量分数为__________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为______________。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为__________,混合气体的平均摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有NH4+、Na+、Mg2+、NO3-4种离子,若向其中加入少量过氧化钠固体后溶液中离子浓度基本保持不变的是( )
A. Mg2+B. Na+C. NH4+D. NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①HCl溶液 ②H2O ③C2H5OH 都能与Na反应放出H2,其产生H2的速率排列顺序正确的是
A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C5H10O,它能发生银镜反应,若将它与H2加成,所得产物的结构简式可能是
A.( CH3)3CCH2OH B.CH3CH2CH(OH)CH2CH3
C.CH3CH(OH)CH2CH2CH3 D.CH3CH2C(CH3)2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sn(核电荷数为50)是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.

(1)Sn元素外围电子排布式为______.
(2)SnCl2的一维链状聚合结构如图1所示,在分子结构中存在的化学键是______.
(3)SnCl4与CCl4中沸点较高的是______.原因是______.
(4)锡的某种氧化物的晶胞如图2,其化学式为______.
(5)解释白锡分子的密度大于灰锡的密度的原因____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com