
【题目】Sn(核电荷数为50)是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.

(1)Sn元素外围电子排布式为______.
(2)SnCl2的一维链状聚合结构如图1所示,在分子结构中存在的化学键是______.
(3)SnCl4与CCl4中沸点较高的是______.原因是______.
(4)锡的某种氧化物的晶胞如图2,其化学式为______.
(5)解释白锡分子的密度大于灰锡的密度的原因____________________.
【答案】 5s25p2 共价键、配位键 SnCl4 SnCl4相对分子质量大,范德华力大 SnO2 配位数大,空间利用率大, 所以密度大。
【解析】(1)Sn属于ⅣA族元素,价电子排布式为5s25p2;(2)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的是Cl,其中一条为配位键;(3)SnCl4与CCl4都属于分子晶体,所以相对分子质量较大的分子,范德华力大,熔沸点较高;(4)O位于体心和面心,数目为2+4×1/2=4,Sn位于顶点和体心,数目为8×1/8+1=2,原子数目比为2:1,化学式为SnO2;(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g) + 2B(g) ![]() 4C(?) + 2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度测量),则下列说法正确的是( )
4C(?) + 2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是![]()
B.增加C,B的平衡转化率不变
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.此时,B的平衡转化率是35%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糠酸又称呋喃甲酸,在食品工业作防腐剂,还可用于合成树脂或医药、香料等的中 间体。以米槺或玉米芯提取的呋喃甲醛为原料合成糠酸反应如下
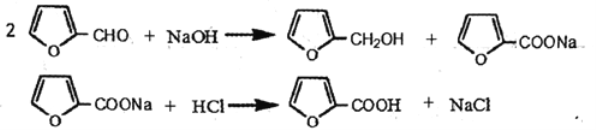
几种有机物性质如下:
名称 | 性状 | 相对分 子质量 | 溶解度 | |||
冷水 | 热水 | 乙醇 | 乙醚 | |||
呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
刚果红试纸pH变色范围:3.0(蓝紫色)~5.0(红色)
呋喃甲酸的实验室制备方法如下:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟。向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.75g。
回答以下问题:
(1) 三颈瓶中反应需要搅拌回流30分钟的原因是__________。
(2) 呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法_________。
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是____________。
A、 直接用50mL乙醚萃取分液
B、 将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、 先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化。配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是___________;判断盐酸加入足量的方法是________________。
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:_____________;水蒸气蒸馏的方法应选择________(填字母序号);
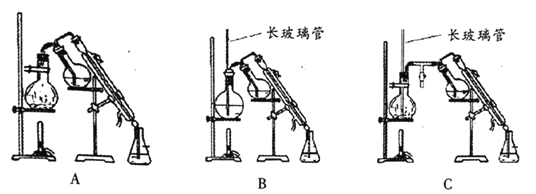
(6)算呋喃甲酸的产率___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,下列判断正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.该物质中不可能含有钾元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列实验问题。
Ⅰ.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435ml。同学们发现实验室内没有450ml的容量瓶,某同学提议用1个200ml容量瓶和1个250ml容量瓶来配制,你认为该提议_________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250ml。则需量取密度为1.84g/ml、98%的浓硫酸________ml。

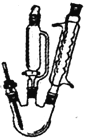
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为________________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是SO2,①、②、③处发生的变化分别说明SO2具有_____________、_____________和_____________(填SO2表现出的性质)。
(3)打开活塞K,a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位置的滤纸滴加______________溶液,该试剂的作用是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A的分子式为C7H6O2,将它与NaHCO3溶液混合加热,有酸性气体产生.那么包括A在内,属于芳香族化合物的A的同分异构体的数目是
A. 5 B. 4 C. 3 D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
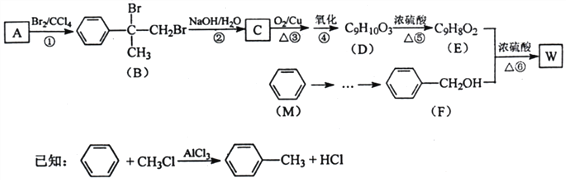
请回答下列问题:
(1)F的化学名称是_______________,①的反应类型是_______________。
(2)B中含有的官能团是_______________(写名称),
(3)D聚合生成高分子化合物的化学方程式为________________。
(4)反应③的化学方程式是___________________。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为_________________。
(6)分子式C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有__________________种(不考虑立体异构)。
(7)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)。____________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com