
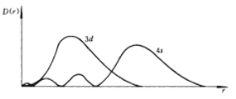
【题目】(1)如图为4s和3d电子云的径向分布图,3d轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,试简单写出理由______。
(2)写出臭氧的Lewis结构式______![]() 只需要写出一种共振式即可
只需要写出一种共振式即可![]() 。
。
(3)根据堆积原理,可以将等径球的密堆积分为![]() 、
、![]() 、
、![]() 、
、![]() 堆积,其中
堆积,其中![]() 堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
堆积形成抽出立方面心晶胞,又叫面心立方最密堆积,其构成的晶胞中含有4个球,写出它们的分数坐标为______。
(4)关于![]() 是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为
是一个特殊的物质,高温下顺磁性,低温下抗磁性,主要是因为![]() 与
与![]() 可以相互转化,低温时主要以双聚分子
可以相互转化,低温时主要以双聚分子![]() 形式存在,高温时主要以单分子
形式存在,高温时主要以单分子![]() 形式存在,同时在高温时
形式存在,同时在高温时![]() 分子中存在离域
分子中存在离域![]() 键的存在,使得氧原子没有成单电子,写出
键的存在,使得氧原子没有成单电子,写出![]() 中存在离域
中存在离域![]() 键为______。
键为______。
(5)在相同的杂化类型和相同的孤对电子对数目时,分子的键角也会不相同,试比较![]() 和
和![]() 中键角的大小,
中键角的大小,![]() ______
______![]() 填“大于”或“小于”或“等于”
填“大于”或“小于”或“等于”![]() 。
。
(6)已知饱和硫化氢的浓度为![]() ,硫化氢的离解常数为
,硫化氢的离解常数为![]() ,
,![]() ,计算饱和硫化氢溶液中氢离子的浓度为______。
,计算饱和硫化氢溶液中氢离子的浓度为______。
【答案】4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽 
![]() 、
、![]() 、
、![]() 、
、![]()
![]() 大于
大于 ![]()
【解析】
(1)![]() 轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽,据此进行分析;
轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽,据此进行分析;
(2)整个分子是V形,中心O是![]() 杂化,分子中含一个3,4大
杂化,分子中含一个3,4大![]() 键;
键;
(3)据面心立方最密堆积,进行分析;
(4)中心原子N采取![]() 杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域
杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域![]() 键是
键是![]() ,据此进行分析;
,据此进行分析;
(5)成键电子对间的距离越远,成键电子对间的排斥力越小;
(6)![]() ,据此进行计算。
,据此进行计算。
(1)![]() 轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,原因是4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽;
轨道离原子核更近,但是根据鲍林的轨道近似能级图填充电子时,先填4s电子,而后填3d电子,原因是4s轨道3d轨道钻得深,可以更好地回避其它电子的屏蔽;
(2)整个分子是V形,中心O是![]() 杂化,分子中含一个3,4大
杂化,分子中含一个3,4大![]() 键,故臭氧的Lewis结构式为
键,故臭氧的Lewis结构式为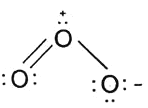 ;
;
(3)面心立方最密堆积,则晶胞中含有4个球,它们的分数坐标为![]() 、
、![]() 、
、![]() 和
和![]() ;
;
(4)中心N原子采取![]() 杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域
杂化,其中一个杂化轨道上填有氮的一个单电子而不是孤对电子,从而此分子中的离域![]() 键是
键是![]() ;
;
(5)氟的电负性大于氢,因此用于![]() 成键的电子对更偏向氟
成键的电子对更偏向氟![]() 或离氮原子核较远
或离氮原子核较远![]() ,氮周围电子密度减小
,氮周围电子密度减小![]() 或
或![]() 成键电子对间的“距离”较远
成键电子对间的“距离”较远![]() ,斥力较小,因而键角较小,故,
,斥力较小,因而键角较小,故,![]() 大于
大于![]() ;
;
(6)![]() 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC
(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
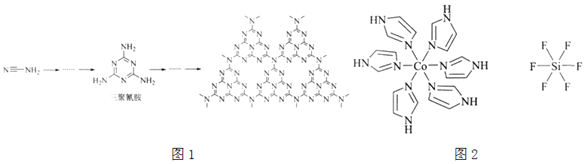
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为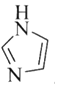
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为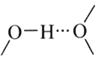
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种具有果香味的有机物(过程中的水或其他物质已省略)。
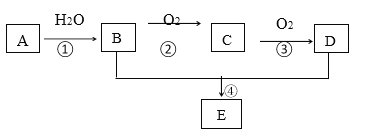
(1)D 分子中的官能团名称是_____。
(2)写出 C 的结构简式:_____
(3)反应①A→B 的反应类型是_____
(4)写出下列反应的化学方程式:B+D→E:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:830℃,在一个密闭容器中发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
CO2(g)+H2(g),平衡常数K=1。某时刻测得容器内各物质的量分别为1.0 mol CO,3.0 mol H2O(g),1.0 mol CO2和1.0mol H2,此时正、逆反应速率的大小关系为:
A. v正= v逆B. v正> v逆C. v正< v逆D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时气体A与气体B在某容器中反应生成气体C,反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图②所示。则下列结论正确的是( )

A.该反应的化学方程式是A+3B![]() 2C
2C
B.该反应的逆反应为吸热反应
C.压强增大,则该反应的正反应速率增大,逆反应速率减小
D.保持压强不变,向容器中充入少量氦气,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丹参素能明显抑制血小板的聚集。其结构如图所示,下列有关说法正确的是
![]()
A. 丹参素苯环上最多能与3mol Br2反应
B. 在Ni催化下1 mol丹参素最多可与4 mol H2加成
C. 1 mol丹参素在一定条件下与足量金属钠反应可生成4 mol H2
D. 丹参素能发生取代、消去、中和、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
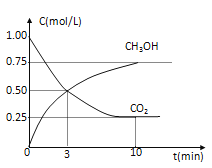
(1) 在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=________mol·L-1·min-1。
(CO2)=________mol·L-1·min-1。
(2)10min时体系的压强与开始时压强之比为______。
(3)该温度下,反应的化学平衡常数数值是__________。
Ⅱ氢气是一种理想的绿色能源,利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如1图所示:
已知:反应I和反应II的平衡常数随温度变化曲线如图2所示。
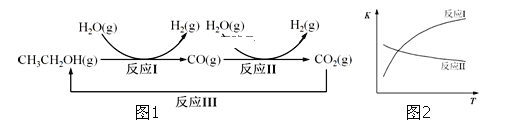
(4)反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ
①H2O的电子式是______
②反应I的热化学方程式是_________________________________
(5)反应II,在进气比[n(CO):n(H2O)不同时,测得相应的CO的平衡转化率见图3(各点对应的反应温度可能相同,也可能不同)
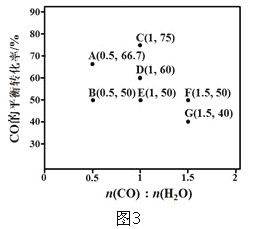
①图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE (填“>”“< ” 或“=”)
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的______相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
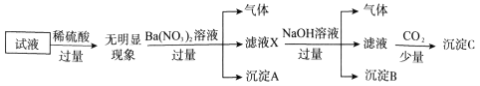
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com