
 2NH3(g)△H=-92.2kJ/mol,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间,
2NH3(g)△H=-92.2kJ/mol,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间, 2NH3(g)△H=-92.2kJ/mol;提高反应速率,缩短达到平衡的时间;
2NH3(g)△H=-92.2kJ/mol;提高反应速率,缩短达到平衡的时间;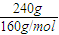 =1.5mol,
=1.5mol,

科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源:怀柔区模拟 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:
某一容积可变的密闭体系中发生下列反应:N2(g) + 3H2(g) ![]() 2NH3(g) + Q(Q>0),回答下列问题:
2NH3(g) + Q(Q>0),回答下列问题:
(1)对于合成氨工业生产条件的选择,下列说法正确的是(选填字母序号) ;
A.温度、压强越大,越有利于化学平衡的正向移动;
B.铁触媒在该温度时活性大;
C.工业生产受动力、材料、设备等条件的限制;
D.使用催化剂有利于提高反应的转化率。
(2)下图是某一时间段中反应速率与反应进程的关系图:

①处于平衡状态的时间段是 。
②在t1、t3、t4时刻,体系中分别是何种条件发生了什么样变化?
t1: ,t3: , t4: 。
③在下列时间段中,氨的百分含量最高的是 (选填代号)。
a.t0~t1 b.t2~t3 c.t3~t4 d.t5~t6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com