
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
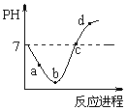
A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
【答案】C
【解析】
据题意,过程分为两个阶段:先向纯水中通入氯气至饱和,再向氯水中滴加NaOH溶液至过量。注意氯气与水的反应可逆,生成的次氯酸为弱酸,次氯酸钠能水解。
A项:曲线起点pH=7为纯水,通入氯气后经a点至b点达到饱和,此过程发生的反应为Cl2+H2O![]() HCl+HClO,A项错误;
HCl+HClO,A项错误;
B项:b点所示溶液为饱和氯水,其中存在Cl2+H2O![]() HCl+HClO,HCl=H++Cl-,HClO
HCl+HClO,HCl=H++Cl-,HClO![]() H++ClO-,故存在Cl2、H2O、HClO三种分子,B项错误;
H++ClO-,故存在Cl2、H2O、HClO三种分子,B项错误;
C项:a、b溶液为氯水,其中H+抑制水电离。b点之后向饱和氯水中滴加NaOH溶液,c点时pH=7,溶质为NaCl、NaClO和少量HClO,水的电离程度较大。d点溶液碱性较强,过量的OH-抑制水电离。故c点溶液中水的电离程度最大,C项正确。
D项:d点溶液中,溶质为NaCl、NaClO和NaOH,故钠离子的物质的量大于氯原子的物质的量,D项错误。
本题选C。


科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为______。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:______________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是______。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
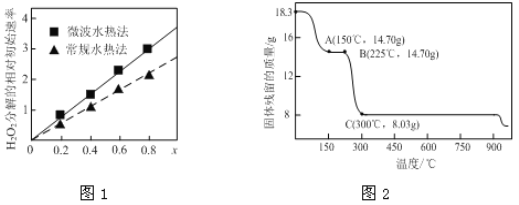
①通过计算确定A点剩余固体的化学成分为________________(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_________________________________________。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。

试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水的原理如图所示。已知海水中含![]() 等离子,电极为惰性电极。下列叙述正确的是
等离子,电极为惰性电极。下列叙述正确的是
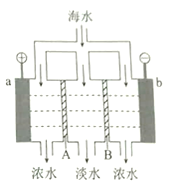
A. A是阳离子交换膜
B. 海水中阴离子移向b电极
C. a的电极反应为![]()
D. b极产生无色气体,出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有![]() 的四种溶液:①
的四种溶液:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)任选上述一种酸性溶液,用化学用语解释其呈酸性的原因:__________.
(2)溶液②的![]() _____________。
_____________。
(3)溶液②、③等体积混合后,溶液中![]() ________
________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2 广泛用于造纸工业、污水处理等。工业上生产NaClO2 的工艺流程如下:
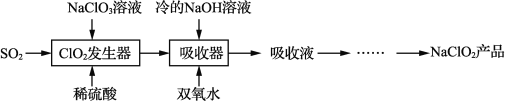
ClO2发生器中的反应为SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4
(1)NaClO3中Cl的化合价_______,上述反应中氧化剂是_______ ,被氧化的元素为_______。请用双线桥法表示该反应中电子转移的方向和数目SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4_______________________反应后,若产生0.6 mol气体,则电子转移的物质的量为 _______mol。
(2)吸收器中反应温度不能高于5℃的可能原因有 _______
(3)反应结束后,向ClO2发生器中通入一定量空气的目的是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)质子数为17、中子数为20的原子可表示为________,Na+的结构示意图________。
(2)焰色反应是_______变化,将碳酸钠进行焰色反应,火焰呈________。
(3)漂白粉有效成分的化学式________,漂白粉发挥漂白作用的反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 0.1molH2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D. 标准状况下,11.2LCH2Cl2中含有质子数为21.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com