
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
【答案】(1)Ⅰ 0.05mol/(L·min)
(2)Ⅰ>Ⅱ>Ⅲ
(3)正反应方向 减小NH3浓度
(4)![]() < 由图可以判断,Ⅱ到Ⅲ采取降低温度的措施,放热反应,降温平衡常数增大。
< 由图可以判断,Ⅱ到Ⅲ采取降低温度的措施,放热反应,降温平衡常数增大。
【解析】
试题分析:
(1)![]() (N2)=
(N2)=![]() =0.05mol/(Lmin),
=0.05mol/(Lmin),
![]() (N2)=
(N2)=![]() =0.0253mol/(Lmin),
=0.0253mol/(Lmin),
![]() (N2)=
(N2)=![]() =0.012mol/(Lmin),
=0.012mol/(Lmin),
故在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是Ⅰ,其值是0.05mol / (L·min)。
(N2)中最大的是Ⅰ,其值是0.05mol / (L·min)。
(2)H2的平衡转化率αⅠ(H2)=![]() ×100%=50%,
×100%=50%,
αⅡ(H2)=![]() ×100%=38%,
×100%=38%,
αⅢ(H2)=![]() ×100%=19.4%,
×100%=19.4%,
则三个阶段H2的转化率大小为:Ⅰ>Ⅱ>Ⅲ 。
(3)由第一次平衡到第二次平衡时各物质的浓度可知,N2浓度由第一次平衡时的1.00mol/L逐渐减低到第二次平衡时的0.62mol/L,H2浓度由第一次平衡时的3.00mol/L逐渐减低到第二次平衡时的0.86mol/L,NH3浓度第一次平衡时的2.00mol/L瞬间降低为0,后逐渐增大到第二次平衡时的0.76mol/L,所以平衡移动的方向是正反应方向,采取的措施是减小NH3浓度。
(4)第Ⅰ阶段时,N2、H2、NH3的平衡浓度分别为1.00mol/L、3.00mol/L、2.00mol/L,化学平衡常数K1=![]() =
=![]() 。第Ⅱ、Ⅲ阶段化学平衡常数K2<K3,理由是由图可以判断,Ⅱ到Ⅲ采取降低温度的措施,放热反应,降温平衡常数增大。
。第Ⅱ、Ⅲ阶段化学平衡常数K2<K3,理由是由图可以判断,Ⅱ到Ⅲ采取降低温度的措施,放热反应,降温平衡常数增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】抗酸药有效成分有:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等,请写出胃酸与氢氧化铝反应的化学方程式____________________________________________;再写出碳酸氢钠与胃酸反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol
B. CO(g)的燃烧热是﹣283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+![]() O2(g)═CO2(g)△H=﹣283.0 kJ/mol
O2(g)═CO2(g)△H=﹣283.0 kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
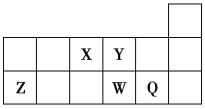
A.离子半径的大小顺序:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B.最高价氧化物对应水化物的酸性:W比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.氯水中有下列平衡Cl2+H2O![]() HCl+HClO,光照后,溶液颜色变浅
HCl+HClO,光照后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取较低的温度
C.用饱和食盐水除去Cl2中的HCl
D.反应2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A. BaCO3能与盐酸反应,可用于治疗胃酸过多
B. MgO熔点高,可用作耐高温材料
C. SO2具有氧化性,可用于漂白品红、织物等
D. NH3极易溶于水,可用作制冷剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com