

| A. | 负极发生氧化反应 | B. | 烧杯中的溶液变为蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
分析 由图中的铜锌原电池可知,Zn活泼,则Zn作负极失电子发生氧化反应,Cu作正极得电子发生还原反应,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能,以此来解答.
解答 解:A、因Zn作负极,则Zn失去电子发生氧化反应,故A正确;
B、由发生电池反应为Zn+H2SO4═ZnSO4+H2↑,Cu不反应,则烧杯中溶液为无色,故B错误;
C、Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,故C错误;
D、该装置通过化学反应将化学能转变为电能,故D错误;
故选:A.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应、能量转化等即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
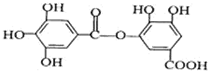 ,下列有关它的性质的叙述中,正确的是( )
,下列有关它的性质的叙述中,正确的是( )| A. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | |
| C. | 在Ni催化下,1 mol 该物质可以和7mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象及结论 |
| 步骤1:取适量“氢铵”配制成溶液,取1~2ml试液于一支洁净的试管中,加足量BaCl2溶液,充分振荡. | ①若出现白色沉淀,证明氢铵中含有(NH4)2CO3; ②若没有明显现象可能含有NH4HCO3 |
| 步骤2:静置,取上层清液少许于另一试管中, 继续滴加滴加适量Ba(OH)2溶液,振荡观察现象. | 若出现白色沉淀,证明氢铵中含有NH4HCO3结合步骤1②,则假设1成立; 结合步骤1①,则假设3成立; 仅在步骤1中产生白色沉淀,则假设2成立;. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| C. | 开发利用太阳能、氢能、风能等清洁能源 | |
| D. | 研究廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. |  和 和 互称同分异构体 互称同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下,Na2CO3比NaHCO3的溶解度小 | |
| B. | 可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 可用加热的方法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | Na2CO3和NaHCO3固体分别与盐酸反应产生等量的CO2时,后者消耗的H+多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Cl-、NO3-、Na+、CO32- | |
| B. | c(H+)=1.0×10-13mol•L的溶液中:MnO4-、K+、SO42-、AlO2- | |
| C. | c(AlO2-)=1.0mol•L的溶液中:SO42-、K+、Cl-、HCO3- | |
| D. | pH=7的溶液中:NO2-、I-、Na+、Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com