

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
②CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1,①+②×2-2×③可以得到反应反应CO2(g)+CH4(g)═2CO(g)+2H2(g),据盖斯定律来计算反应的焓变;
(2)①催化剂只能改变反应速率,不能改变化学平衡;
②b、c点均未达到平衡状态,升高温度,化学反应速率加快,CO2的转化率较大;
(3)图象分析生产甲醇的气体最佳流动速率,二氧化碳转化率最大,甲醇产量最大;使用单组份ZnO时反应速率虽然最快,但是由图可知,CO2转化率、CH3OH产率均过低;
(4)①反应是气体系数和减小的反应,则熵变小于零;
②Kp等于各产物平衡压强系数次方的乘积和各个反应物平衡浓度系数次方的乘积的比值;
③为提高CO2的平衡转化率,使得化学平衡正向移动即可.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJ•mol-1
②CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJ•mol-1
③2CO(g)+O2(g)═2CO2(g)△H3=c kJ•mol-1,①+②×2-2×③可以得到反应反应CO2(g)+CH4(g)═2CO(g)+2H2(g),据盖斯定律来计算反应的焓变△H=(a+2b-2c)kJ•mol-1;故答案为:a+2b-2c;
(2)①催化剂只能改变反应速率,不能改变化学平衡,所以最终不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CO2的转化率相同,故a点所代表的状态不是平衡状态,故答案为:不是;
②b、c点均未达到平衡状态,c点温度比b点高,反应速率较快,故CO2的转化率较大;
故答案为:b、c点都未达到平衡状态,c点温度高,反应速率快,二氧化碳的转化率较大;
(3)①图象分析生产甲醇的气体最佳流动速率,二氧化碳转化率最大,甲醇产量最大,分析图象数据可知最佳流动速率在3600以上都可以;故答案为:3600;
②使用单组份ZnO时反应速率虽然最快,但是由图可知,CO2转化率、CH3OH产率均过低实际生产中没有意义,故不采用;
故答案为:使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用.
(4)①反应是气体系数和减小的反应,则熵变小于零,则△S<0,故答案为:<;
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的Kp等于各产物平衡压强系数次方的乘积和各个反应物平衡浓度系数次方的乘积的比值,即KP=$\frac{p({C}_{2}{H}_{4})•{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})•{p}^{6}({H}_{2})}$,故答案为:$\frac{p({C}_{2}{H}_{4})•{p}^{4}({H}_{2}O)}{{p}^{2}(C{O}_{2})•{p}^{6}({H}_{2})}$;
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或提高氢气和二氧化碳物质的量的比值,故答案为:增大压强;提高氢气和二氧化碳物质的量的比值.
点评 本题考查了化学平衡的影响、热化学方程式的计算应用,图象分析是关键,题目难度中.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:多选题
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.| A. | a<b | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 上述反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 负极发生氧化反应 | B. | 烧杯中的溶液变为蓝色 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法、热还原法、热分解法 | B. | 热还原法、热分解法、电解法 | ||
| C. | 热分解法、热还原法、电解法 | D. | 电解法、热分解法、热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
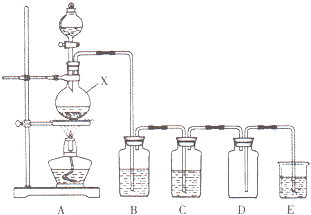 实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.
实验室中常用二氧化锰与浓盐酸共热制取氯气.某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味,表明乙醇已被铜氧化为乙醛 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0~t2时,v正始终大于v逆 | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ | |
| D. | t2时刻改变的条件可以是向密闭容器中加C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )
在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)=3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同$\frac{n(N{H}_{3})}{n(S{O}_{2})}$下,温度与SO2的转化率关系如图,下列说法正确的是( )| A. | 脱硫反应△H<0 | |
| B. | 及时从体系中除去水,平衡常熟增大 | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | $\frac{n(N{H}_{3})}{n(S{O}_{2})}$:a<b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com