
【题目】探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O![]() [CuCl2],甲醛是具有强还原性的气体。
[CuCl2],甲醛是具有强还原性的气体。
下列说法正确的是
A.红色沉淀的主要成分不是Cu2O,可能是Cu
B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C.从甲醛的结构 ![]() 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(![]() ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D.含有-CHO的有机物都可以被新制Cu(OH)2氧化
【答案】A
【解析】
向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,配制成新制的Cu(OH)2,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,甲醛具有强还原性,与新制的Cu(OH)2发生氧化还原反应,迅速产生红色沉淀,其周围剧烈产生无色气体,将所得沉淀洗净后加入浓盐酸,不溶解,根据已知信息:Cu2O![]() [CuCl2],可知,红色沉淀不是Cu2O,可能是Cu,甲醛被氧化为生成一氧化碳和氢气,由于水浴加热,甲醛具有挥发性,生成的无色气体中混有甲醛气体,据此分析解答。
[CuCl2],可知,红色沉淀不是Cu2O,可能是Cu,甲醛被氧化为生成一氧化碳和氢气,由于水浴加热,甲醛具有挥发性,生成的无色气体中混有甲醛气体,据此分析解答。
A.根据已知信息,Cu2O![]() [CuCl2],实验操作(2)中,红色沉淀洗净后加入浓盐酸,不溶解,则可以确定红色沉淀的主要成分不是Cu2O,可能是Cu,故A正确;
[CuCl2],实验操作(2)中,红色沉淀洗净后加入浓盐酸,不溶解,则可以确定红色沉淀的主要成分不是Cu2O,可能是Cu,故A正确;
B.根据分析,由于甲醛与新制的Cu(OH)2发生氧化还原反应可能会生成一氧化碳和氢气,生成的气体中会混有甲醛气体,甲醛和氢气都具有还原性,可将灼热的CuO还原为铜单质,产生红色固体,不能证明含有CO,故B错误;
C.甲醛可被氧化生成甲酸,甲酸继续被氧化生成碳酸,与新制的Cu(OH)2的反应是在碱性条件下进行的,不是酸性条件下进行,生成的应该是碳酸盐,不可能产生二氧化碳,故C错误;
D.根据实验操作(3),甲酸钠中也含有醛基,与新制的Cu(OH)2反应,未观察到明显现象,含有-CHO的甲酸钠没有被新制Cu(OH)2氧化,故D错误;
答案选A。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:___;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.人们习惯上把电解饱和食盐水的工业叫做氯碱工业。如下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液。请回答以下问题:
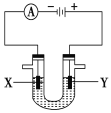
(4)X极上的电极反应式是:__________。
(5)检验Y电极反应产物的方法是_______。
(6)电解饱和NaCl溶液的离子方程式是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g) C(s) +2H2(g) ΔH=+75 kJ·mol1;消碳反应:CO2(g) +C(s) 2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如下图。

下列说法正确的是
A.高压利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
D.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3·![]() H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。
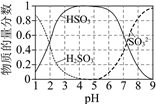
Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e,同时生成1 mol O2。
(1)SO2造成的环境问题主要是_____________________。
(2)ZnO将SO2转化为ZnSO3·![]() H2O的化学方程式是_____________________________。
H2O的化学方程式是_____________________________。
(3)将ZnSO3·![]() H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·
H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·![]() H2O,其中溶液pH随时间变化的曲线如下:
H2O,其中溶液pH随时间变化的曲线如下:

①pH=3.5的溶液中含S(+4价)的离子主要是____________________。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是________________。
③解释O3氧化可防止管道堵塞的原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值为1:1 ⑦混合气体总质量 ⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧B. ①③④⑤C. ①②③④⑤⑦D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol(反应热)
SO2(g) ΔH=269.8kJ/mol(反应热)
D.Fe+S![]() FeS ΔH=95.6kJ/mol(反应热)
FeS ΔH=95.6kJ/mol(反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com