
【题目】现有下列十种物质:①AgCl②铜③液态醋酸④CO2⑤H2SO4⑥Ba(OH)2固体⑦NaHCO3⑧稀硝酸⑨熔融FeCl3 ⑩NaHSO4
(1)上述状态下可导电的是_________;(填序号,下同)属于强电解质的是________;属于非电解质的是______.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为_______________________________
(3)用⑨的饱和溶液制备Fe(OH)3胶体的离子方程式_______________________ 足量的④通入⑥的溶液中的离子方程式______________;
【答案】②⑧⑨ ①⑤⑥⑦⑨⑩ ④ Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ CO2+OH﹣=HCO3﹣
Fe(OH)3(胶体)+3H+ CO2+OH﹣=HCO3﹣
【解析】
(1)物质导电的原因是有自由移动的电子或自由移动的离子;在水溶液中或者熔化状态下能完全电离的是电解质属于强电解质,只能部分电离的属于弱电解质;在水溶液中和熔化状态下都不能导电的化合物属于非电解质,包括非金属氧化物、氨气和大多数有机物;
(2)H++OH-═H2O,表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水;
(3)加热时FeCl3水解生成Fe(OH)3胶体;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡。
(1)①AgCl中离子不能自由移动,故不能导电;在熔融状态下能完全电离,故为强电解质;②铜能导电;但铜是单质,故既不是电解质也不是非电解质;③液态醋酸中无自由移动的离子,故不能导电;但在水溶液中能部分电离,故为弱电解质;④CO2无自由移动的离子,故不能导电;在水溶液中导电和其本身无关,在熔融状态下不能导电,故为非电解质;⑤H2SO4中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑥Ba(OH)2固体中无自由移动的离子,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;⑦NaHCO3中无自由移动的离子,故不能导电;但在水溶液中能完全电离,故为强电解质;⑧稀硝酸有自由移动的离子,故能导电;但由于是混合物,故既不是电解质也不是非电解质;⑨熔融FeCl3中有自由移动的离子,故能导电;在水溶液中和熔融状态下能完全电离,故为强电解质;⑩NaHSO4中离子不能自由移动,故不能导电;但在水溶液中和熔融状态下能完全电离,故为强电解质;
故能导电的为②⑧⑨;是强电解质的是①⑤⑥⑦⑨;是非电解质的是④;
(2)离子方程式H++OH-═H2O表示可溶性强酸和可溶性强碱发生酸碱中和反应生成可溶性盐和水,故Ba(OH)2和HNO3的反应符合,化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,其水解方程式为Fe3++3H2O
Fe(OH)3(胶体)+3HCl,其水解方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡,离子方程式为CO2+OH-=HCO3-。
Fe(OH)3(胶体)+3H+;当足量的二氧化碳通入氢氧化钡溶液中时生成碳酸氢钡,离子方程式为CO2+OH-=HCO3-。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方法收集Cl2
B.洗涤油污时热的纯碱溶液比冷的纯碱溶液效果更好
C.浓氨水中加入氢氧化钠固体时产生刺激性气味的气体
D.工业上使用催化剂提高SO2与O2合成SO3的效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
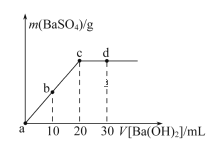
A.硫酸溶液的体积为25 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液中c(OH-)=0.05mol·L-1
D.溶液的导电能力:c<d<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究1-溴丙烷是否发生消去反应,用下图装置进行实验,观察到酸性高锰酸钾溶液褪色。下列叙述不正确的是
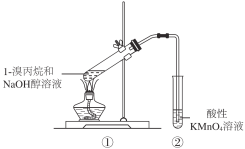
A. ②中一定发生了氧化还原反应
B. ①试管中也可能发生了取代反应
C. ①试管中一定发生了消去反应生成不饱和烃
D. 若②中试剂改为溴水,观察到溴水褪色,则①中一定发生了消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA表示阿伏加德罗常数,则下列说法中正确的是
①该硫原子的相对原子质量为12a/b ②m g该硫原子的物质的量为m/aNA mol
③12C原子的摩尔质量是12g或bNA g ④a g该硫原子所含的电子数为16
A.①③④B.②③④C.①②④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
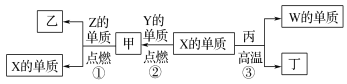
A.反应③可用于工业上制取W的单质B.X位于元素周期表第二周期ⅣA族
C.甲、丙、丁均为酸性化合物D.工业上通过电解乙来制取Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
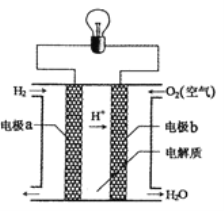
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com