
 ,故答案为:N;
,故答案为:N; ;
;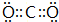 ,故答案为:
,故答案为: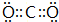 ;
;

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:

| A、能与银氨溶液发生反应的只有丙 |
| B、既能与FeCl3溶液发生显色反应,又能和溴水反应的只有乙 |
| C、四种物质中,乙与丙构成同分异构体 |
| D、四种物质都能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol/(L?min) |
| B、0.04mol/(L?min) |
| C、0.08mol/(L?min) |
| D、0.8mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量位居第一位 |
| Z | 短周期中,其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | Z | |
| 结构 或 性质 |
最高价氧化物是温室气 体,其原子的最外层电子 数是次外层电子数的2 倍 |
最高价氧化物对 应的水化物与其 气态氢化物反应 得到离子化合物 |
氧化物是常见的两性化合物 | 最高正价与最 低负价之和为 零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
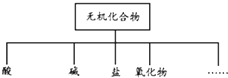 无机化合物可根据其组成和性质进行分类.
无机化合物可根据其组成和性质进行分类.| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② |
③ ④Ba(OH0)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com