
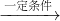 4NO+6H2O;4NO+3O2+2H2O→4HNO3
4NO+6H2O;4NO+3O2+2H2O→4HNO3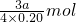 =3.75amol,
=3.75amol,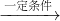 4NO+6H2O
4NO+6H2O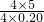 L=25L,
L=25L,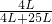 =0.14,
=0.14,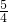 +12.0)=150.0 x=1.5(mol)
+12.0)=150.0 x=1.5(mol)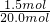 ×100%=7.5%
×100%=7.5% 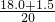 ×100%=97.5%,
×100%=97.5%,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
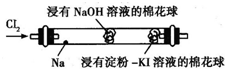 某化学教师为“氯气与金属钠的反应”设计了如图所示的装置(加热装置省略)来替代相关的教材实验装置.先给钠预热,当钠熔化成圆球时,撤火,通入氯气,即可观察到钠着火燃烧,并产生大量白烟.
某化学教师为“氯气与金属钠的反应”设计了如图所示的装置(加热装置省略)来替代相关的教材实验装置.先给钠预热,当钠熔化成圆球时,撤火,通入氯气,即可观察到钠着火燃烧,并产生大量白烟.查看答案和解析>>
科目:高中化学 来源: 题型:单选题
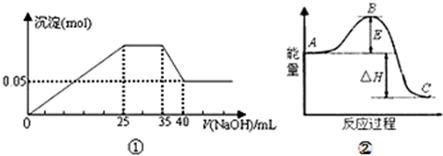
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com