
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
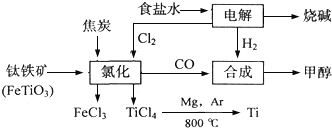
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
【答案】 2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑ 1mol 2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑ 1mol 2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
2FeCl3+2TiCl4+6CO Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化 10 2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O
【解析】(1)电解食盐水反应的离子方程式为:2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑;氯离子在阳极上失去电子生成氯气,标准状况下的11.2L的氯气的物质的量为0.5mol,转移电子的物质的量为1mol。(2)在氯化过程中,FeTiO3与C、Cl2反应生成FeCl3、CO、TiCl4,化学方程式为:2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑;氯离子在阳极上失去电子生成氯气,标准状况下的11.2L的氯气的物质的量为0.5mol,转移电子的物质的量为1mol。(2)在氯化过程中,FeTiO3与C、Cl2反应生成FeCl3、CO、TiCl4,化学方程式为:2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO;(3)Mg和Ti都有强还原性,在高温条件易空气中氧气被氧化,而在Ar气氛中可以防止被氧化。(4)因2H2+CO——CH3OH,2Cl﹣+2H2O
2FeCl3+2TiCl4+6CO;(3)Mg和Ti都有强还原性,在高温条件易空气中氧气被氧化,而在Ar气氛中可以防止被氧化。(4)因2H2+CO——CH3OH,2Cl﹣+2H2O![]() 2OH﹣+H2↑+Cl2↑,2FeTiO3+6C+7Cl2
2OH﹣+H2↑+Cl2↑,2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO;192t甲醇的物质的量为6×106mol,需要氢气为12×106mol,需要一氧化为6×106mol,而生成6×106mol一氧化碳消耗氯气的物质的量为7×106mol,需要补充的氢气的物质的量为5×106mol,即10t。
2FeCl3+2TiCl4+6CO;192t甲醇的物质的量为6×106mol,需要氢气为12×106mol,需要一氧化为6×106mol,而生成6×106mol一氧化碳消耗氯气的物质的量为7×106mol,需要补充的氢气的物质的量为5×106mol,即10t。
(5)甲醇在负极失去电子被氧化为二氧化碳,生成的二氧化碳与氢氧化钾溶液反应生成碳酸钾,则负极上的电极反应式为:2CH3OH﹣12e﹣+16OH﹣=2CO32﹣+12H2O。
点晴:书写电化学半反应的技巧是由方程式画出双线桥,表示得、失电子转移关系,找出还原剂及被氧化后的产物,这里特别要注意被氧化后产物与介质是否反应,若反应,则两步合并书写,然后由电子守恒、电荷守恒、质量守恒配平即可。当然也可由总反应减去正极反应式就是负极反应式。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色。
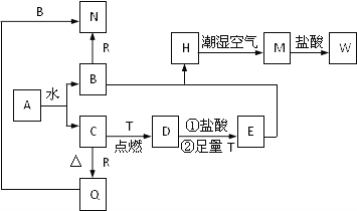
(1)写出下列物质的化学式:A:____________;E:__________。
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:__________________。
(3)按要求写方程式:
B和R反应生成N的离子方程式:___________________________________;
M→W的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列方程式:
(1) ____P+____Br2+____H2O=____H3PO4+____HBr
(2) ___KMnO4+___HCl(浓)=___KCl+___MnCl2+___Cl2↑+___H2O
(3)___FeSO4 + ___H2O + ___O2 = ___Fe2(SO4)3 + ___Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)
A.该冶炼锌的反应属于置换反应
B.煤炭中起作用的主要成分是C
C.冶炼Zn的反应方程式为:ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D.倭铅是指金属锌和铅的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
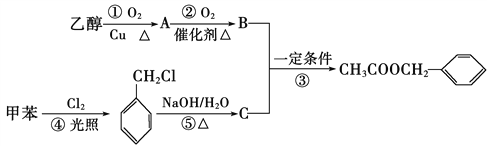
(1)B、C的结构简式分别为________、________。
(2)写出反应①、③、④的化学方程式:
①______________________________________________________________;
④______________________________________________________________。
③______________________________________________________________;
(3)反应①、③、④、⑤的反应类型分别为①______③______,④_____,⑤_____。
(4)反应______(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(5)A中官能团的名称是___________,检验这种官能团除了可以用银氨溶液还可以用______(填名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时下列说法正确的是( )
A.在pH=12的溶液中由水提供的c(OH﹣)一定是10﹣12mol?L﹣1
B.将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7
C.将pH=6和pH=4的两种盐酸等体积混合后其c(OH﹣)接近0.5×(10﹣8+10﹣10) mol?L﹣1
D.Na2CO3溶液中:c(Na+)>c(CO ![]() )>c(OH﹣)>c(HCO
)>c(OH﹣)>c(HCO ![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
4NO(g) +6H2O(g), △H=-a kJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是
A. 2分钟反应放出的热.量值小于0.1akJ
B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ·L-1 ·min-1
C. 2分钟内NH3的转化率是50%
D. 2分钟末 c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com