
【题目】25℃时下列说法正确的是( )
A.在pH=12的溶液中由水提供的c(OH﹣)一定是10﹣12mol?L﹣1
B.将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7
C.将pH=6和pH=4的两种盐酸等体积混合后其c(OH﹣)接近0.5×(10﹣8+10﹣10) mol?L﹣1
D.Na2CO3溶液中:c(Na+)>c(CO ![]() )>c(OH﹣)>c(HCO
)>c(OH﹣)>c(HCO ![]() )>c(H+)
)>c(H+)
【答案】D
【解析】解:A.pH=12的溶液中c(OH﹣)=10﹣2molL﹣1 , 如为盐溶液,促进水的电离,则由水提供的c(OH﹣)是10﹣2molL﹣1 , 如为碱溶液,由Kw=c(OH﹣)×c(H+)=10﹣14可知,c(H+)=10﹣12mol/L,则水提供的c(OH﹣)一定是10﹣12molL﹣1 , 故A错误;B.酸碱的强弱未知,反应后的酸碱性不能确定,故B错误;
C.将pH=6和pH=4的两种盐酸等体积混合后c(H+)≈ ![]() ×10﹣4mol/L,则混合后其c(OH﹣)=2×10﹣10mol/L,故C错误;
×10﹣4mol/L,则混合后其c(OH﹣)=2×10﹣10mol/L,故C错误;
D.Na2CO3为强碱弱酸盐,水解呈碱性,且以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(CO ![]() )>c(OH﹣)>c(HCO
)>c(OH﹣)>c(HCO ![]() )>c(H+),故D正确.
)>c(H+),故D正确.
故选D.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
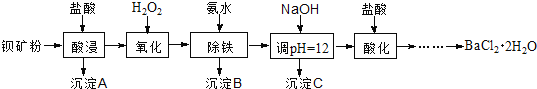
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配置准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠,对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.1molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.2000molL﹣1的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液(mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
1 | 20.00 | 0.00 | 23.18 |
2 | 20.00 | 1.02 | 21.00 |
3 | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中粗配溶液要用到的主要玻璃仪器除量筒外还需、 .
(2)高锰酸钾溶液应盛装于(填“酸式”或“碱式”)滴定管中:在使用滴定管前,应检查(填部位名称)是否漏水,在确保滴定管不漏水后方可使用;润洗滴定管内壁后的液体应从滴定管的(填“下部放入”或“上口倒入”)预置的烧杯中;步骤二中滴定终点的判断方法是: .
(3)下列滴定操作会导致测量结果偏高的是 .
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点读数时俯视
D.滴定时锥形瓶中有液体溅出
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
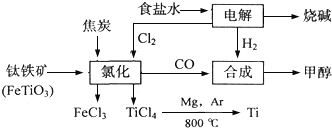
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
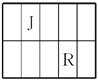
(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_____________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.在蔗糖水解后的溶液中,先加入稍过量的碱再滴加银氨溶液,验证产物中的葡萄糖
B.淀粉中加入20%的H2SO4溶液在酒精灯上加热,使其水解
C.向蔗糖中加入浓硫酸后加热,一段时间后得到葡萄糖和果糖
D.向淀粉水解后的溶液中先加氢氧化钠中和催化剂硫酸,再加入碘水,观察溶液是否变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
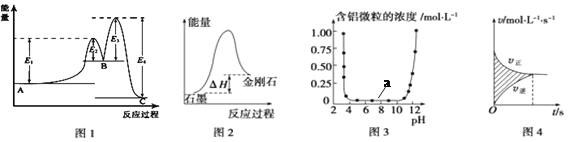
A. 图1所示,A→C反应的ΔH =E1-E2
B. 图2所示,金刚石比石墨稳定
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D. 图4所示,图中阴影部分面积的含义是(υ正-υ逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+ ![]() O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+
O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+ ![]() O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+
O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol 相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol 相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com