
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
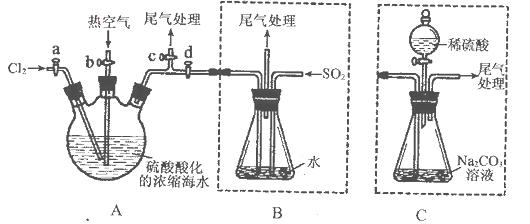
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤@B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
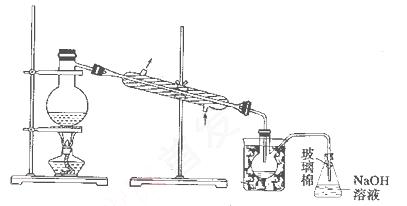
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
科目:高中化学 来源: 题型:
在下列溶液中,能大量共存的一组离子是
A. pH=1的溶液中:NH4+ 、 Fe2+ 、SO42-、Cl-
B. 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+
C. c(Al3+)=0.1 mol/L的溶液中 :Na+、K+、AlO2-、SO42-
D.由水电离出的c(H+)=1×10-13 mol/L 的溶液中:Na+、HCO3-、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、一氧化碳、葡萄糖、甲烷燃烧的热化学方程式分别为
H2(g)+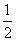 O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1
O2(g) = H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+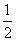 O2(g) = CO2(g) ΔH=-283.0 kJ·mol-1
O2(g) = CO2(g) ΔH=-283.0 kJ·mol-1
C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是
A.C6H12O6 B.CH4 C.H2 D.CO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置用途正确的是
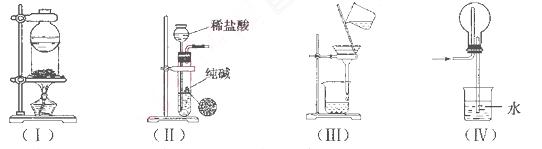
A.装置(I)用于I2与NH4Cl混合物的分离
B. 装置(Ⅱ)用于制取少量纯净的CO2气体
C.装置(III)用于去除Fe(0H)3胶体中含有的可溶性物质
D.装置(Ⅳ)用于HC1的吸收,以防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性: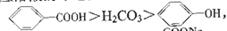 综合考虑反应物的转化率和原料成本等
综合考虑反应物的转化率和原料成本等
因素,将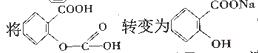 的最佳方法是
的最佳方法是
A.与稀H2SO4共热后,加入足量NaOH溶液
B.与稀H2SO4共热后,加入足量溶液
C.与足量的NaOH溶液共热后,再加入适量H2SO4
D.与足量的NaOH溶液共热后,再通入足量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.4CuO(s)=2Cu2O(s)+O2(g)在室温下不能自发进行,说明该反应△H>0
B.向稀醋酸中加入醋酸钠固体,溶液pH升高的主要原因是醋酸钠水解呈碱性
C.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
FeS(s)+H2O(g),其他条件不变时增大压强,反应速率V正(H2S)和H2S的平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
水是地球表面上普遍存在的化合物,我们可以用我们学习的物质结构与性质的有关知识去认识它。
(1)水的组成元素为氢和氧。氧的基态原子的价电子排布图为______________,氧的第一电离能在同周期元素中由大到小排第______位。
(2)根据杂化轨道理论,水分子中的氧原子采取的杂化形式是_______;根据价层电子对互斥理论,水分子的VSEPR模型名称为______________;根据等电子体原理,写出水合氢离子的一个等电子体(写结构式)_____________。
(3)水分子可以形成许多水合物。
①水分子可以作配体和铜离子形成水合铜离子[Cu(H2O)4]2+,1mol水合铜离子中含有σ键数目为_________。
②图1是水合盐酸晶体H5O2+·Cl-中H5O2+离子的结构。
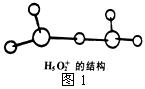
在该离子中,存在的作用力有______________。
a.配位键 b.极性键 c.非极性键 d.离子键
e.金属键 f.氢键 g.范德华力 h.π键 i.σ键
(4)韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。请从结构上解释生成暖冰的原因_________________________________。
(5)最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。图2为冰的一种骨架形式,依此为单位向空间延伸。
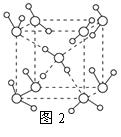
①该冰中的每个水分子有_________个氢键;
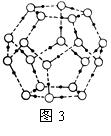
②冰融化后,在液态水中,水分子之间仍保留有大量氢键将水分子联系在一起,分子间除了无规则的分布及冰结构碎片以外,一般认为还会有大量呈动态平衡的、不完整的多面体的连接方式。右图的五角十二面体是冰熔化形成的理想多面体结构。假设图3中的冰熔化后的液态水全部形成右图的五角十二面体,且该多面体之间无氢键,则该冰熔化过程中氢键被破坏的百分比为________。
③如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰连接类似?____________;
④已知O-H…O距离为295pm,列式计算此种冰晶体的密度 g/cm3。(已知2952=8.70×104,2953=2.57×107,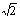 =1.41,
=1.41,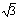 =1.73)
=1.73)
查看答案和解析>>
科目:高中化学 来源: 题型:
能源可划分为一级能源和二级能源,直接来自自然界的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)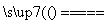 2H2(g)+O2(g),该反应需要吸收大量的热,下列叙述正确的是 ( )
2H2(g)+O2(g),该反应需要吸收大量的热,下列叙述正确的是 ( )
A.水煤气是二级能源 B.水力是二级能源
C.天然气是二级能源 D.电能是一级能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com