
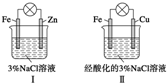
| A. | Ⅰ中不能形成原电池 | |
| B. | Ⅱ中负极反应是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正极反应是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀 |
分析 A、Ⅰ会发生金属的吸氧腐蚀;
B、金属铁的吸氧腐蚀中负极上是金属铁失电子的氧化反应;
C、金属铁的吸氧腐蚀中正极上是氧气得电子的还原反应,根据电解质环境书写电极反应式;
D、亚铁离子的盐溶液中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀.
解答 解:A、Ⅰ会发生金属Zn的吸氧腐蚀,符合原电池的构成条件,故A错误;
B、Ⅱ中发生金属铁的吸氧腐蚀,负极上是金属铁失电子的氧化反应,Fe-2e-═Fe2+,故B错误;
C、金属铁的吸氧腐蚀中正极上是氧气得电子的还原反应,在酸性环境下,电极反应:O2+4H++4e-═2H2O,故C错误;
D、Ⅱ中发生金属铁的吸氧腐蚀,负极上是金属铁失电子生成亚铁离子的过程,溶液中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀,故D正确.
故选D.
点评 本题考查学生原电池的构成条件以及电极反应式的书写知识,注意知识的迁移应用是关键,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、HCO3-、K+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com