
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
科目:高中化学 来源: 题型:选择题
| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
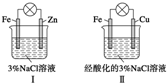
| A. | Ⅰ中不能形成原电池 | |
| B. | Ⅱ中负极反应是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正极反应是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.
B.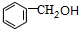 C.
C. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 试剂及方法 |
| 除去细沙中混有的碘 | A |
| 证明某些雨水样品呈酸性 | C |
| 鉴别甲烷和乙烯 | D |
| 除去开水壶内壁的水垢 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
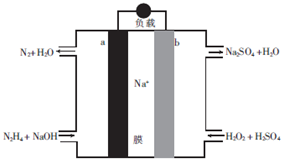
| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
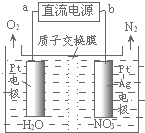 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com