
ЎҫМвДҝЎҝЈЁ14·ЦЈ©№ӨТөЙПУГЙБРҝҝуЈЁЦчТӘіЙ·ЦОӘZnSЈ¬»№ә¬УРFe2O3өИФУЦКЈ©ОӘФӯБПЙъІъZnSO4ЎӨ7H2OөД№ӨТХБчіМИзПВЈә

ЈЁ1Ј©ВЛФьAҫӯCS2МбИЎәуҝЙ»сөГТ»ЦЦөӯ»ЖЙ«ёұІъЖ·Ј¬Жд»ҜС§КҪОӘ ЎЈ
ЈЁ2Ј©ҪюИЎ№эіМЦРFe2(SO4)3өДЧчУГКЗ ЎЈ
ЈЁ3Ј©іэМъ№эіМҝШЦЖИЬТәөДpHФЪ5.4ЧуУТЈ¬ёГ·ҙУҰөДАлЧУ·ҪіМКҪОӘ ЎЈёГ№эіМФЪҝХЖшИлҝЪҙҰЙијЖБЛТ»ёцАаЛЖБЬФЎЕзН·өДЧ°ЦГЈ¬ЖдДҝөДКЗ ЎЈ
ЈЁ4Ј©ЦГ»»·ЁіэЦШҪрКфАлЧУЛщУГОпЦКCОӘ ЎЈ
ЈЁ5Ј©БтЛбРҝөДИЬҪв¶ИУлОВ¶ИЦ®јдөД№ШПөИзПВұнЈә
ОВ¶И/Ўж | 0 | 20 | 40 | 60 | 80 | 100 |
ИЬҪв¶И/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
ҙУіэЦШҪрКфәуөДБтЛбРҝИЬТәЦР»сөГБтЛбРҝҫ§МеөДКөСйІЩЧчОӘ Ўў Ўў№эВЛЎўёЙФпЎЈ
Ўҫҙр°ёЎҝЈЁ1Ј©SЈ»ЈЁ2Ј©ЧцСх»ҜјБЈ»
ЈЁ3Ј©4Fe2+ + O2 + 6H2O = 4FeOOHЎэ + 8H+ ФцҙуҝХЖшУлИЬТәөДҪУҙҘГж»эЈ¬јУҝм·ҙУҰЛЩВКЎЈ
ЈЁ4Ј©ZnЈЁРҝЈ©Ј»ЈЁ5Ј©60ЎжМхјюПВХф·ўЕЁЛхЎўҪөОВҪбҫ§ЈЁГҝҝХ2·ЦЈ¬№І12·ЦЈ©ЎЈ
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәЈЁ1Ј©ВЛФьAҫӯCS2МбИЎәуҝЙ»сөГТ»ЦЦөӯ»ЖЙ«ёұІъЖ·Ј¬Жд»ҜС§КҪSЈ»ЈЁ2Ј©ҪюИЎ№эіМЦРFe2(SO4)3өДЧчУГКЗЧчСх»ҜјБЈ¬°С»№ФӯРФөДОпЦКСх»ҜЈ»ЈЁ3Ј©іэМъ№эіМҝШЦЖИЬТәөДpHФЪ5.4ЧуУТЈ¬ХвКұ»б·ўЙъіБөн·ҙУҰЈ¬РОіЙFeOOHіБөнЈ¬ёщҫЭБчіМНјЦРөДОпЦКҝЙЦӘЈәёГ·ҙУҰөДАлЧУ·ҪіМКҪОӘ4Fe2+ + O2 + 6H2O = 4FeOOHЎэ + 8H+Ј»ёГ№эіМФЪҝХЖшИлҝЪҙҰЙијЖБЛТ»ёцАаЛЖБЬФЎЕзН·өДЧ°ЦГЈ¬ЖдДҝөДКЗФцҙуҝХЖшУлИЬТәөДҪУҙҘГж»эЈ¬јУҝм·ҙУҰЛЩВКЎЈЈЁ4Ј©іэИҘФУЦКөДФӯФтКЗІ»ФцІ»јхЈ¬јҙІ»ФцјУРВөДФУЦКЈ¬І»јхЙЩұ»МбҙҝөДОпЦКұҫЙнЈ¬УЙУЪФЪИЬТәЦРЦчТӘә¬УРZnSO4Ј¬ЛщТФЦГ»»·ЁіэЦШҪрКфАлЧУЛщУГОпЦКCОӘZnЈ»ЈЁ5Ј©ёщҫЭZnSO4өДИЬҪв¶ИұнҝЙЦӘZnSO4өДИЬҪв¶ИЛжОВ¶ИөДЙэёЯ¶шФцҙуЈ¬ФЪ60/ЎжКұЧоёЯЈ¬ЛщТФҙУіэЦШҪрКфәуөДБтЛбРҝИЬТәЦР»сөГБтЛбРҝҫ§МеөДКөСйІЩЧчОӘ60ЎжМхјюПВХф·ўЕЁЛхЎўҪөОВҪбҫ§ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝұкЧјЧҙҝцПВЈ¬Пт100 mL H2SұҘәНИЬТәЦРНЁИлSO2ЖшМеЈ¬ЛщөГИЬТәpHұд»ҜИзНјЦРЗъПЯЛщКҫЎЈПВБР·ЦОцХэИ·өДКЗ

AЈ® bөгЛ®өДөзАліМ¶ИұИcөгЛ®өДөзАліМ¶Иҙу
BЈ®ЗвБтЛбөДЛбРФұИСЗБтЛбөДЛбРФЗҝ
CЈ®ФӯH2SИЬТәөДОпЦКөДБҝЕЁ¶ИОӘ0.05 molЎӨLЈӯ1
DЈ®aөг¶ФУҰИЬТәөДөјөзРФұИdөгЗҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТ»¶ЁБҝөДСОЛбёъ№эБҝөДМъ·Ы·ҙУҰКұЈ¬ОӘБЛјх»ә·ҙУҰЛЩВКЈ¬ЗТІ»У°ПмЙъіЙЗвЖшөДЧЬБҝЈ¬ҝЙПтСОЛбЦРјУИлККБҝөД
ўЩNaOH(№ММе) ўЪH2O ўЫHCl ўЬCH3COONa(№ММе)
A. ўЩўЪ B. ўЪўЫ C. ўЫўЬ D. ўЪўЬ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВұнОӘФӘЛШЦЬЖЪұнөДТ»Іҝ·ЦЈ¬Зл»ШҙрУР№ШОКМвЈә
Че ЦЬЖЪ ЎЎ | ўсA | ўтA | ўуA | ўфA | ўхA | ўцA | ўчA | 0 |
¶ю | ўЩ | ўЪ | ||||||
Иэ | ўЫ | ўЬ | ўЭ | ўЮ | ўЯ | ўа | ||
ЛД | ўб | ўв |
(1)ўЭәНўаөДФӘЛШ·ыәЕКЗ________әН________ЎЈ
(2)ұнЦРЧо»оЖГөДҪрКфЧоёЯјЫСх»ҜОпөДЛ®»ҜОп»ҜС§КҪКЗ________Ј¬·ЗҪрКфРФЧоЗҝөДФӘЛШөҘЦК»ҜС§КҪКЗ________ Ј¬ұнЦРДЬРОіЙБҪРФЗвСх»ҜОпөДФӘЛШ¶ФУҰЧоёЯјЫСх»ҜОп»ҜС§КҪКЗ_______ ЎЈ
(3)·ЦұрРҙіцўЬФӘЛШөДЗвСх»ҜОпУлўЮЎўўбЧоёЯјЫСх»ҜОпөДЛ®»ҜОп·ҙУҰөДАлЧУ·ҪіМКҪЈә_____________________Ј¬_________________________ЎЈ
(4)ҝЙТФұИҪПўЯУлўвөҘЦКСх»ҜРФөДАлЧУ·ҪіМКҪОӘЈә_______________________ЎЈ
(5)ұнЦРРОіЙ»ҜәПОпЦЦАаЧо¶аөДФӘЛШөДФӘЛШ·ыәЕКЗ______Ј¬РОіЙөДЦЦАа·ұ¶аөДХвАа»ҜәПОпЦРЈ¬ЧојтөҘөД»ҜәПОпөД»ҜС§КҪКЗ________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЈЁ1Ј©ИзНјЛщКҫЈ¬ИфCОӘЕЁПхЛбЈ¬өзБчұнЦёХл·ўЙъЖ«ЧӘЈ¬Bөзј«ІДБПОӘFe ,Aөзј«ІДБПОӘCuЈ¬ФтBөзј«өДөзј«·ҙУҰКҪОӘ______________Ј¬Aөзј«өДөзј«·ҙУҰКҪОӘ Ј»·ҙУҰҪшРРТ»¶ОКұјдәуИЬТәCөДpHҪ« (МоЎ°ЙэёЯЎұЎ°ҪөөНЎұ»тЎ°»щұҫІ»ұдЎұ)ЎЈ
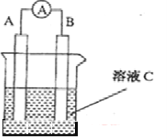
ЈЁ2Ј©ОТ№ъКЧҙҙТФВБҝХЖшәЈЛ®өзіШЧчОӘДЬФҙөДРВРНөДәЈЛ®ұкЦҫөЖЈ¬ТФәЈЛ®ОӘөзҪвЦКИЬТәЈ¬ҝҝҝХЖшЦРөДСхЖшК№ВБІ»¶ПСх»Ҝ¶шІъЙъөзБчЈ¬Ц»ТӘ°СөЖ·ЕИләЈЛ®Кэ·ЦЦУЈ¬ҫН»б·ўіцТ«СЫөД°Ч№вЎЈФтөзФҙөДёәј«ІДБПКЗ________Ј¬ёәј«·ҙУҰОӘ___________Ј»Хэј«·ҙУҰОӘ________________ЎЈ
ЈЁ3Ј©ИЫСОөзіШҫЯУРёЯөД·ўөзР§ВКЈ¬Тт¶шКЬөҪЦШКУЈ¬ ҝЙУГLi2CO3әНNa2CO3өДИЫИЪСО»мәПОпЧчөзҪвЦКЈ¬COОӘёәј«ИјЖшЈ¬ҝХЖшУлCO2өД»мәПЖшОӘХэј«ЦъИјЖшЈ¬ЦЖөГФЪ650 ЎжПВ№ӨЧчөДИјБПөзіШЈ¬НкіЙУР№ШөзіШ·ҙУҰКҪЎЈёәј«·ҙУҰКҪОӘ2COЈ«2CO32-Јӯ4eЈӯ=4CO2Ј¬Хэј«·ҙУҰКҪОӘ________________Ј¬өзіШЧЬ·ҙУҰКҪОӘ___________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦКөД·ЦАаәПАнөДКЗЈЁ Ј©
AЈ®Сх»ҜОпЈәCO2ЎўNOЎўSO2ЎўH2O
BЈ®јоЈәNaOHЎўKOHЎўBaЈЁOHЈ©2ЎўNa2CO3
CЈ®п§СОЈәNH4ClЎўNH4NO3ЎўЈЁNH4Ј©2SO4ЎўNH3H2O
DЈ®јоРФСх»ҜОпЈәNa2OЎўCaOЎўMn2O7ЎўAl2O3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіҝЙДж·ҙУҰ:2A(g)![]() B(g)+D(g)ФЪ3ЦЦІ»Н¬МхјюПВҪшРРЈ¬BәНDөДЖрКјЕЁ¶ИҫщОӘ0Ј¬·ҙУҰОпAөДЕЁ¶ИЛж·ҙУҰКұјдөДұд»ҜЗйҝцИзПВұнЈә
B(g)+D(g)ФЪ3ЦЦІ»Н¬МхјюПВҪшРРЈ¬BәНDөДЖрКјЕЁ¶ИҫщОӘ0Ј¬·ҙУҰОпAөДЕЁ¶ИЛж·ҙУҰКұјдөДұд»ҜЗйҝцИзПВұнЈә
КөСй РтәЕ | Кұјд/min ЕЁ¶И/molЎӨL-1 ОВ¶И/Ўж | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)КөСй1ЦРЈ¬ФЪ1020 minДЪЈ¬ТФОпЦКAұнКҫөДЖҪҫщ·ҙУҰЛЩВКОӘ______molЎӨL-1Ј¬50minКұЈ¬vЈЁХэЈ©_____ЈЁМоЎ°<Ўұ Ў°>Ўұ »тЎ°=ЎұЈ©v(Дж)ЎЈ
(2)020 minДЪЈ¬КөСй2ұИКөСй1өД·ҙУҰЛЩВК________(МоЎ°ҝмЎұ»тЎ°ВэЎұ)Ј¬ЖдФӯТтҝЙДЬКЗ__________ЎЈ
(3)КөСй3ұИКөСй1өД·ҙУҰЛЩВК____________(МоЎ°ҝмЎұ»тЎ°ВэЎұЈ©Ј¬ЖдФӯТтКЗ_______________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘОВ¶ИTКұЛ®өДАлЧУ»эіЈКэОӘKW, ёГОВ¶ИПВ, Ҫ«ЕЁ¶ИОӘamolЎӨ L-1өДТ»ФӘЛбHAУлbmolЎӨ L-1өДТ»ФӘјоBOHөИМе»э»мәП, ҝЙЕР¶ЁёГИЬТәіКЦРРФөДТАҫЭКЗ
AЈ®a = b
BЈ®»мәПИЬТәөДpH = 7
CЈ®»мәПИЬТәЦР, c ЈЁH+Ј© = ![]() molЎӨL-1
molЎӨL-1
DЈ®»мәПИЬТәЦР, c ЈЁH+Ј©+c ЈЁB+Ј© = c ЈЁOH-Ј©+c ЈЁA-Ј©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРОпЦКөДЛ®ИЬТәТтЛ®Ҫв¶шіКЛбРФөДКЗ
AЈ®NaHCO3 BЈ®NaNO3 CЈ®CaCl2 DЈ®NH4Cl
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com